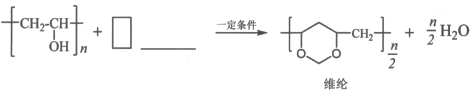
题目内容
13.如图所示为工业生产中三氯氧磷的制取流程及产品部分性质: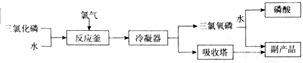
已知:①三氯化磷为无色澄清液体,极易水解生成亚磷酸(H3PO3,二元弱酸),同时放出大量热;
②Knp[Ca3(PO4)2]=2×10-29;③$\root{-3}{0.2}$=0.585.结合流程及相关信息,回答下列问题;
(1)写出三氯化磷水解的化学方程式PCl3+3H2O=H3PO3+3HCl,写出亚磷酸与足量氢氧化钠溶液反应的化学方程式H3PO3+2NaOH=Na2HPO3+2H2O.
(2)三氯氧磷分子中磷元素化合价为+5,0.1molPOCl3最多可消耗4mol•L-1NaOH溶液150mL.
(3)流程中反应釜中生成的氧化产物与还原产物的物质的量之比为1:2.
(4)工业生产中会产生含磷废水(H3PO4、H3PO3),处理时先加入适量漂白粉,再加入生石灰调节pH,若处理后的废水中c(PO43-)<10-5mol/L可认为PO43-沉淀完全,则此时c(Ca2+)至少为5.85×10-7mol•L-1.
(5)某同学想测定三氯氧磷产品纯度,设计方案为:取一定量的产品在碱性条件下水解,然后加入足量AgNO3溶液,过滤、洗涤干燥,称量生成沉淀的质量即为氯化银的质量,由此计算产品纯度,该方案有明显错误或不足,请指出:沉淀不仅含有氯化银,还含有氢氧化银、磷酸银.
(6)磷酸燃料电池是当前商业化发展得最快的一种燃料电池,使用磷酸为电解质,工作温度150~200℃,比质子交换膜燃料电池和碱性燃料电池工作温度高,如图是甲烷、氧气,磷酸燃料电池工作示意图:
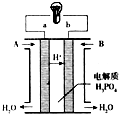
该电池a极为电池负极,电极反应为CH4-8e-+2H2O=8H++CO2,该极电极反应要比质子交换膜燃料电池的速度快,可能原因是该电池工作温度高.
分析 (1)三氯化磷中P为+3价,可水解生成亚磷酸和盐酸;亚磷酸为二元酸;
(2)POCl3中P元素化合价为+5价,可水解生成磷酸和盐酸;
(3)流程中发生PCl3+Cl2+H2O=POCl3+2HCl,以此解答;
(4)根据Ksp[Ca3(PO4)2]=c2(PO43-)×c3(Ca2+)=2×10-29计算;
(5)沉淀中含有氯化银、AgOH以及磷酸银等;
(6)由氢离子移动方向可知a为负极,b为正极,正极发生氧化反应,工作温度较高,反应速率大.
解答 解:(1)三氯化磷中P为+3价,可水解生成亚磷酸和盐酸,方程式为PCl3+3H2O=H3PO3+3HCl,亚磷酸为二元酸,发生H3PO3+2NaOH=Na2HPO3+2H2O,
故答案为:PCl3+3H2O=H3PO3+3HCl;
(2)POCl3中P元素化合价为+5价,可水解生成磷酸和盐酸,则0.1molPOCl3可水解生成0.1mol磷酸、0.3mol盐酸,最多可消耗4mol•L-1NaOH溶液0.6mol,体积为$\frac{0.6mol}{4mol/L}$=0.15L=150mL,故答案为:+5;150;
(3)流程中发生PCl3+Cl2+H2O=POCl3+2HCl,氧化剂为Cl2,还原产物为HCl,还原剂为PCl3,POCl3为氧化产物,则氧化产物与还原产物的物质的量之比为1:2,
故答案为:1:2;
(4)Ksp[Ca3(PO4)2]=c2(PO43-)×c3(Ca2+)=2×10-29,若处理后的废水中c(PO43-)<10-5mol/L,
则c(Ca2+)=$\root{3}{\frac{2×1{0}^{-29}}{(1{0}^{-5})^{2}}}$mol/L=5.85×10-7mol/L,
故答案为:5.85×10-7mol/L;
(5)产品在碱性条件下水解,溶液中存在氢氧根离子以及磷酸根离子,则加入硝酸银,可生成氯化银、AgOH以及磷酸银等,
故答案为:沉淀不仅含有氯化银,还含有氢氧化银、磷酸银;
(6)由氢离子移动方向可知a为负极,b为正极,正极发生氧化反应,电极方程式为CH4-8e-+2H2O=8H++CO2,由于工作温度较高,则反应速率大,
故答案为:负;CH4-8e-+2H2O=8H++CO2;该电池工作温度高.
点评 本题考查较为综合,为高频考点,侧重于学生的分析、实验和计算能力的考查,注意把握实验原理以及物质的性质,为解答类型题目的关键,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 前者多 | B. | 后者多 | C. | 二者相等 | D. | 无法比较 |
| A. | 草酸稀溶液加水稀释,溶液中所有离子浓度均减小 | |
| B. | NaHC2O4溶液中有:2c(Na+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-) | |
| C. | pH=3的草酸与pH=12的NaOH溶液混合至中性时,溶液中有:c(Na+)=c(HC2O4-)+2c(C2O42-) | |
| D. | 等浓度的草酸和碳酸相比,溶液中由水电离出来的c(H+)前者更多 |
| A. | 在Na2S溶液中:c(Na+)=c(HS-)+c(S2-) | |
| B. | 乙烯的燃烧热为akJ•mol-1(a>0),则乙烯燃烧的热化学方程式可表示为C2H4(g)+3O2(g)=2CO2(g)+2H2O(g)△H=-akJ•mol-1 | |
| C. | 钢铁发生吸氧腐蚀的正极反应式为O2+4e-+2H2O=4OH- | |
| D. | 从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH- |
 .
.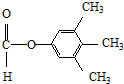 、
、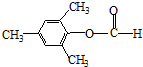 .
.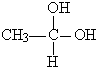 →CH3-CHO+H2O
→CH3-CHO+H2O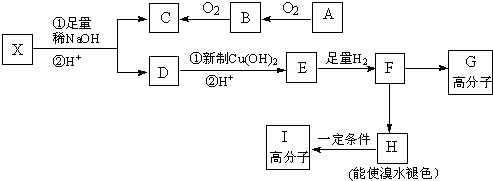
 ;
;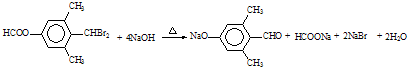 ;
;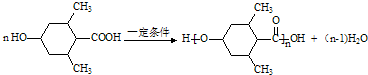 ;
; .
.
 ,其工业合成路线如下:
,其工业合成路线如下: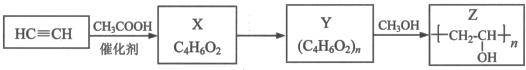
 ;
;