题目内容
17.微生物燃料电池因具有原料广泛、操作条件温和、清洁高效和资源利用率高、无污染等特点而被人们所重视.以用葡萄糖作底物的燃料电池为例,其正负极反应式如下:正极反应:6O2+24H++24e-$\frac{\underline{\;催化剂\;}}{\;}$12H2O 负极反应:C6H12O6+6H2O-24e-$\frac{\underline{\;催化剂\;}}{\;}$6CO2↑+24H+ 则有关该电池的下列说法正确的是( )
| A. | 该电池的工作环境是高温条件 | |
| B. | 作为负极的葡萄糖(C6H12O6)在变化中失去电子,被还原 | |
| C. | 该电池的电解质溶液是强酸性溶液,如浓硫酸或硝酸等 | |
| D. | 该电池的总反应为C6H12O6+6O2$\frac{\underline{\;催化剂\;}}{\;}$6CO2+6H2O |
分析 A、该电池是燃料原电池,反应条件温和;
B、葡萄糖在反应中失去电子被氧化;
C、浓硫酸能和有机物发生脱水反应;
D、将正负极反应方程式相加即可得总反应方程式.
解答 解:A、该电池是燃料原电池,反应条件温和,所以不是高温条件,故A错误;
B、C元素的化合价升高,则葡萄糖在反应中失去电子被氧化,故B错误;
C、浓硫酸能和有机物发生脱水反应,电池的电解质溶液不能是浓硫酸,故C错误;
D、将正负极反应方程式相加即可得总反应方程式为:C6H12O6+6O2$\frac{\underline{\;催化剂\;}}{\;}$6CO2+6H2O,故D正确;
故选:D.
点评 本题考查化学电源新型电池,明确原电池原理解答本题的关键,题目难度中等.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
2.下列粒子属等电子体的是( )
| A. | NO和O2 | B. | CH4和NH4+ | C. | NH2?和H2O2 | D. | HCl和H2O |
7.等质量的铁与过量的盐酸在不同的试验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得到如图,则曲线a、b、c、d所对应的试验组别是( )
| 组别 | c(HCl)(mol•L-1) | 温度(℃) | 铁的状态 | 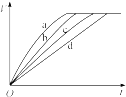 |
| 1 | 2.0 | 25 | 块状 | |
| 2 | 2.5 | 30 | 块状 | |
| 3 | 2.5 | 50 | 粉末状 | |
| 4 | 2.5 | 30 | 粉末状 |
| A. | 3-4-2-1 | B. | 1-2-4-3 | C. | 4-3-2-1 | D. | 1-2-3-4 |

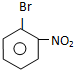 B
B 或
或 C
C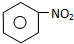 E
E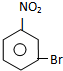
 .
.