8.等温等压下,关于等质量H2、D2、T2三种气体的下列叙述中正确的是( )
| A. | 密度之比1:2:3 | B. | 质子数之比6:3:2 | C. | 中子数之比0:3:4 | D. | 体积之比6:3:2 |
6.下列单体中在一定条件下发生加聚反应生成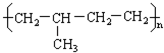 的是( )
的是( )
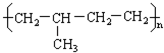 的是( )
的是( )| A. | CH2=CH2和CH4 | B. |  | ||
| C. | CH3-CH=CH2和CH2=CH2 | D. | 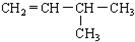 |
5.已知反应A2(g)+2B2(g)?2AB2(g)△H<0,下列说法正确的( )
| A. | 升高温度,正向反应速率增加,逆向反应速率减小 | |
| B. | 升高温度有利于反应速率增加,从而缩短达到平衡的时间 | |
| C. | 若反应在密闭体系内进行,通入He气,体系压强增大,反应速率增大 | |
| D. | 若反应在恒压体系内进行,通往He气,体系压强不变,反应速率不变 |
4.下列有机物水解时,断键位置不正确的是( )
①
②
③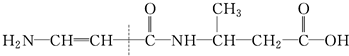
④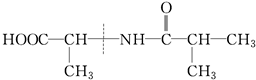
①

②

③
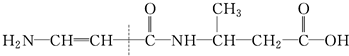
④

| A. | ①② | B. | ②③④ | C. | ①③ | D. | 全部 |
20.W、X、Y、Z、R为五种短周期主族非金属元素,它们在元素周期表中的相对位置如图所示.下列关于五种元素的说法正确的是( )
0 167475 167483 167489 167493 167499 167501 167505 167511 167513 167519 167525 167529 167531 167535 167541 167543 167549 167553 167555 167559 167561 167565 167567 167569 167570 167571 167573 167574 167575 167577 167579 167583 167585 167589 167591 167595 167601 167603 167609 167613 167615 167619 167625 167631 167633 167639 167643 167645 167651 167655 167661 167669 203614
| W | X | R | |
| Y | Z |
| A. | 粒子半径:原子半径最大的是W,简单阴离子半径最小的是R | |
| B. | 单质:氧化性最强的是Z,还原性最强的是Y | |
| C. | 最高价氧化物对应水化物:酸性最强的是Z,水溶性最差的是Y | |
| D. | 最简单氢化物:沸点最高的是X,稳定性最差的是W |


 .
.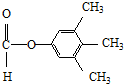 、
、 .
.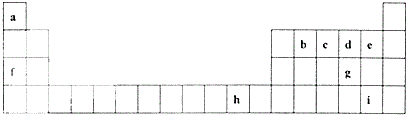 下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素.
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素. .
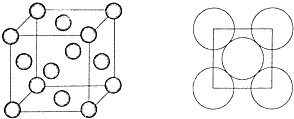
.


 ;D的核磁共振氢谱共有3组峰.
;D的核磁共振氢谱共有3组峰.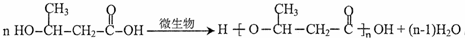 .
.
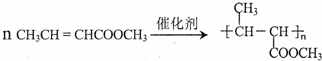 .
.