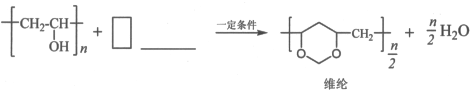
题目内容
8.等温等压下,关于等质量H2、D2、T2三种气体的下列叙述中正确的是( )| A. | 密度之比1:2:3 | B. | 质子数之比6:3:2 | C. | 中子数之比0:3:4 | D. | 体积之比6:3:2 |
分析 A.同温同压下,密度之比等于摩尔质量之比;
B.根据n=mMmM知,相同质量,物质的量之比与摩尔质量成反比,H2、D2、T2三种气体的摩尔质量比=2g/mol:4g/mol:6g/molH2、D2、T2分子都含有2个质子,据此判断;
C.相同质量,物质的量之比与摩尔质量成反比,结合H2、D2、T2分子含有中子数判断;
D.相同质量,物质的量之比与摩尔质量成反比,同温同压下,体积之比等于物质的量之比;
解答 解:A.根据ρ=mVmV=nMnVmnMnVm=MvmMvm知,密度与摩尔质量成正比,故H2、D2、T2三种气体的摩尔质量之比=2g/L:4g/mol:6g/mol=1:2:3,故A正确;
B.根据n=mMmM知,等质量H2、D2、T2三种气体的物质的量之比=1212:1414:1616=6:3:2,H2、D2、T2分子都含有2个质子,故质子数之比=气体物质的量之比=6:3:2,故B正确;
C.等质量H2、D2、T2三种气体的物质的量之比之比=1212:1414:1616=6:3:2,H2、D2、T2分子分别含有中子数为0、2、4,故中子数之比=6×0:3×2:2×4=0:6:8=0:3:4,故C正确;
D.等质量H2、D2、T2三种气体的物质的量之比之比=1212:1414:1616=6:3:2,同温同压下,体积之比等于物质的量之比=6:3:2,故D正确;
故选ABCD.
点评 本题考查以物质的量为中心的计算,涉及阿伏伽德罗定律的应用,题目难度不大,侧重于公式的联合应用,注意H2、D2、T2三者的微粒构成.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6. 如图为元素周期表中短周期的一部分,下列有关X、Y、Z、W、T五种元素的叙述中错误的是( )
如图为元素周期表中短周期的一部分,下列有关X、Y、Z、W、T五种元素的叙述中错误的是( )
 如图为元素周期表中短周期的一部分,下列有关X、Y、Z、W、T五种元素的叙述中错误的是( )
如图为元素周期表中短周期的一部分,下列有关X、Y、Z、W、T五种元素的叙述中错误的是( )| A. | X与Y形成的阴离子只有XY32- | |
| B. | Z元素的最高价氧化物对应水化物的酸性最强 | |
| C. | 六种元素分别形成的单质晶体中,X的熔、沸点可能最高 | |
| D. | 这五种元素两两组合,形成只有极性键的非极性分子的物质数大于3 |
19.有关核外电子运动规律的描述错误的是( )
| A. | 核外电子质量很小,在原子核外作高速运动 | |
| B. | 核外电子的运动规律与普通物体不同 | |
| C. | 在电子云示意图中,通常用小黑点来表示电子 | |
| D. | 在电子云示意图中,小黑点密表示电子在核外空间单位体积内电子出现的机会多 |
13.m mol乙炔跟n mol氢气在密闭容器中反应,当其达到平衡时,生成p mol乙烯,将平衡混合气体完全燃烧生成CO2和H2O,所需氧气的物质的量是( )
| A. | (3m+n)mol | B. | (52m+n2•3p52m+n2∙3p)mol | C. | (3m+n+2p)mol | D. | (52m+n252m+n2)mol |
17.关于碱金属元素的说法中正确的是( )
| A. | ⅠA族元素都是碱金属元素 | |
| B. | 碱金属单质可将铜从其盐溶液中置换出来 | |
| C. | 金属钾具有强还原性,K+具有强氧化性 | |
| D. | Cs常温下与水反应会发生爆炸 |
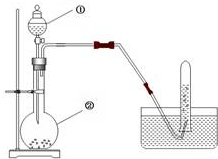 实验室用电石制取乙炔的装置如下图所示,请填空:
实验室用电石制取乙炔的装置如下图所示,请填空:
 .
.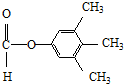 、
、 .
.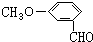 ,请按要求完成下列问题:
,请按要求完成下列问题: ;
;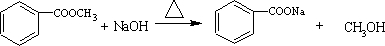 .
. .
. ,其工业合成路线如下:
,其工业合成路线如下: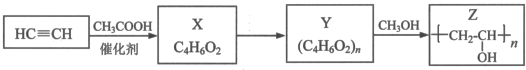
 ;
;