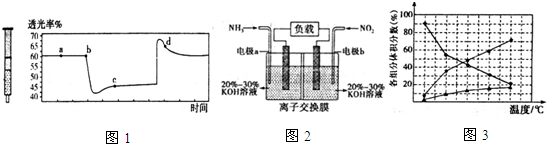
12.黑火药爆炸时可发生如下反应:4S+16KNO3+16C→3K2SO4+4K2CO3+K2S+12CO2↑+8N2↑,下列有关说法正确的是( )
| A. | KNO3只发生氧化反应 | B. | 反应消耗12g C时电子转移5mol | ||
| C. | 还原产物只有K2S和 N2 | D. | 被氧化与被还原的S为1:3 |
11.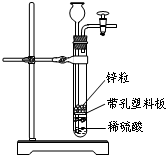 某一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液不足.为达到实验目的,则可以从长颈漏斗中加入下列试剂中的( )
某一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液不足.为达到实验目的,则可以从长颈漏斗中加入下列试剂中的( )
 某一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液不足.为达到实验目的,则可以从长颈漏斗中加入下列试剂中的( )
某一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液不足.为达到实验目的,则可以从长颈漏斗中加入下列试剂中的( )| A. | NaNO3溶液 | B. | 四氯化碳 | C. | 苯 | D. | Na2CO3溶液 |
10.下列物质的制备线索中,不符合工业生产实际的是( )
| A. | NH3$→_{催化剂}^{O_{2}}$NO$\stackrel{O_{2}•H_{2}O}{→}$HNO3 | |
| B. | 浓缩海水$\stackrel{CI_{2}}{→}$Br2$\stackrel{鼓入热空气}{→}$Br2(粗产品)$\stackrel{精制}{→}$Br2 | |
| C. | MnO2$→_{加热}^{浓HCI}$Cl2$\stackrel{Ca(OH)_{2}}{→}$漂白粉 | |
| D. | 石油$\stackrel{裂解}{→}$乙烯$→_{加热}^{催化剂}$聚乙烯 |
9.关于羟基的说法正确的是( )
| A. | 羟基可以电离成H+和O2- | B. | 1mol羟基共有9mol电子 | ||
| C. | 与氢氧根离子是类别异构 | D. | 羟基只存在于分子晶体中 |
8.${\;}_{\;}^{16}$O、${\;}_{\;}^{18}$O是氧元素的两种原子,下列说法正确的是( )
| A. | ${\;}_{\;}^{16}$O和${\;}_{\;}^{18}$O的物理性质相同、化学性质不相同 | |
| B. | 通过化学反应可实现${\;}_{\;}^{16}$O与${\;}_{\;}^{18}$O之间相互转化 | |
| C. | ${\;}_{\;}^{16}$O和${\;}_{\;}^{18}$O的原子核外电子排布的方式不相同 | |
| D. | ${\;}_{\;}^{16}$O和${\;}_{\;}^{18}$O能形成三种化学性质相同的氧分子 |
7.下列分离方法中,和物质的溶解度无关的是( )
| A. | 萃取 | B. | 纸上层析 | C. | 过滤 | D. | 蒸馏 |
4.如图图示与对应的叙述不相符的是( )
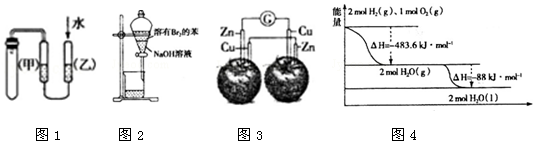

| A. | 图1的目的是检验装置的气密性 | |
| B. | 图2中分液漏斗振荡静置后,上层液体颜色变浅 | |
| C. | 图3中电流计的指针不发生偏转 | |
| D. | 图4液态水分解的热化学方程式为:2H2O(1)═2H2(g)+O2(g)△H=+571.6KJ/mol |
3.化学在人类生活中扮演着重要角色,下列叙述正确的是( )
0 167457 167465 167471 167475 167481 167483 167487 167493 167495 167501 167507 167511 167513 167517 167523 167525 167531 167535 167537 167541 167543 167547 167549 167551 167552 167553 167555 167556 167557 167559 167561 167565 167567 167571 167573 167577 167583 167585 167591 167595 167597 167601 167607 167613 167615 167621 167625 167627 167633 167637 167643 167651 203614
| A. | 氯处理饮用水时,在夏季的杀菌效果比在冬季好 | |
| B. | 利用化学反应可实现12C到14C的转化 | |
| C. | “血液透析”利用了胶体的性质 | |
| D. | 气象环境报告中新增的“PM2.5”是对一种新分子的描述 |
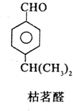 $→_{一定条件}^{试剂X}$A
$→_{一定条件}^{试剂X}$A B$→_{一定条件}^{2H_{2},Ni}$C$→_{△}^{Cu,O_{2}}$
B$→_{一定条件}^{2H_{2},Ni}$C$→_{△}^{Cu,O_{2}}$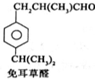
 $→_{-H_{2}O}^{△}$
$→_{-H_{2}O}^{△}$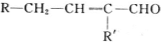
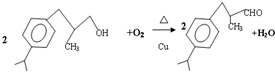 +H20.
+H20. 、
、 .
.