题目内容
5.化学反应原理在生产和科研中有着重要的应用,请利用相关知识回答下列问题.(1)一定条件下在密闭容器中加入NH4I发生反应:
a.NH4I(s)?NH3(g)+HI(g) b.2HI(g)?H2(g)+I2(g)
则反应a的平衡常数表达式为K=[NH3]•[HI];达到平衡后,扩大容器体积,反应b的移动方向不移动(填正向、逆向或不移动)
(2)氮元素的+4价氧化物有两种,它们之间发生反应:2NO2?N2O4△H<0,将一定量的NO2充入注射器中后封口,图1是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是
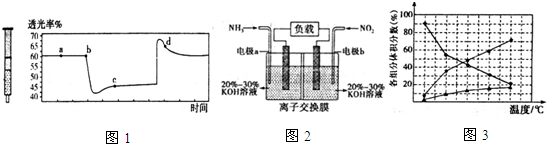
A.b点的操作是压缩注射器
B.c点与a点相比,c(NO2)增大,c(N2O4)减小
C.若不忽略体系温度变化,且没有能量损失,则b、c两点的平衡常数Kb>Kc
D.d点:v(正)>v(逆)
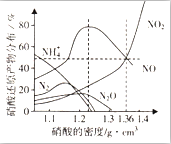
(3)利用反应6NO2+8NH3═7N2+12H2O构成原电池,能消除氮氧化物的排放,减轻环境污染,装置如图2所示.
①电极a为负极,其电极反应式为2NH3-6e-+60H-=N2+6H2O.
②当有2.24LNO2(标准状况下)被处理时,转移电子为0.4mol.
③为使电池持续放电,该离子交换膜需选用阴离子交换膜.
(4)使用硼氢化钠(NaBH4)为诱导剂,可使Co2+与肼(N2H4)在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体.
①写出该反应的离子方程式2Co2++N2H4+4OH-=2Co↓+N2↑+4H2O.
②在纳米钴的催化作用下,肼(N2H4)可分解生成两种气体,其中一种气体能使湿润的红色石蕊试纸变蓝.若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图3所示,为抑制肼的分解,可采取的合理措施有降低反应温度 (任写一种).
分析 (1)化学平衡常数K=$\frac{生成物浓度幂次方}{反应物浓度幂次方}$,固体和纯液体不列入;达到平衡后,扩大容器体积,平衡向气体 体积增大的方向移动;
(2)该反应是正反应气体体积减小的放热反应,压强增大平衡虽正向移动,但二氧化氮浓度增大,混合气体颜色变深,压强减小平衡逆向移动,但二氧化氮浓度减小,混合气体颜色变浅,据图分析,b点开始是压缩注射器的过程,气体颜色变深,透光率变小,c点后的拐点是拉伸注射器的过程,气体颜色变浅,透光率增大,据此分析;
(3)由反应6NO2+8NH3═7N2+12H2O可知,反应中NO2为氧化剂,NH3为还原剂,则A为负极,B为正极,负极发生氧化反应,正极发生还原反应,结合电解质溶液呈碱性解答;
(4)①依据题意,反应物为Co2+与肼(N2H4)、碱性条件下存在OH-,生成物为:钴单质,据此得出Co的化合价降低,故N的化合价升高,只能为0价,即氮气,依据氧化还原反应得失电子守恒回答即可;
②由图1得知:温度越高,肼的百分含量越低,即分解的越快.
解答 解:(1)NH4I为固态,不列入平衡常数表达式,所以其平衡常数表达式为:K=[NH3]•[HI],反应2HI(g)?H2(g)+I2(g)前后气体物质的量不变,所以增大容器体积,平衡不移动,故答案为:K=[NH3]•[HI];不移动;
(2)A、b点开始是压缩注射器的过程,气体颜色变深,透光率变小,故A正确;
B、c点是压缩注射器后的情况,二氧化氮和四氧化二氮的浓度都增大,故B错误;
C、b点开始是压缩注射器的过程,平衡正向移动,反应放热,导致T(b)<T(c),升温平衡逆向移动,平衡常数减小,所以Kb>Kc,故C正确;
D、c点后的拐点是拉伸注射器的过程,d点是平衡向气体体积增大的逆向移动过程,所以v(逆)>v(正),故D错误;
故答案为:AC;
(3)①由反应6NO2+8NH3═7N2+12H2O可知,反应中NO2为氧化剂,NH3为还原剂,则a为负极,b为正极,负极电极方程式为2NH3-6e-+60H-=N2+6H2O,
故答案为:负;2NH3-6e-+60H-=N2+6H2O;
②当有2.24L NO2(标准状况)即0.1mol 被处理时,转移电子为0.1mol×(4-0)=0.4mol,故答案为:0.4;
③原电池工作时,阴离子向负极移动,为使电池持续放电,离子交换膜需选用阴离子交换膜,防止二氧化氮反应生成硝酸盐和亚硝酸盐,导致原电池不能正常工作,
故答案为:阴离子;
(4)①依据题意,反应物为Co2+与肼(N2H4)、碱性条件下存在OH-,生成物为:钴单质,据此得出Co的化合价降低,故N的化合价升高,只能为0价,即氮气,据此得出还有水生成,氧化还原反应中存在得失电子守恒以及元素守恒,故此反应的离子反应方程式为:2Co2++N2H4+4OH-=2Co↓+N2↑+4H2O,
故答案为:2Co2++N2H4+4OH-=2Co↓+N2↑+4H2O;
②由图1可知,温度越高,肼的体积分数含量越低,故要抑制肼的分解,应降低反应温度,故答案为:降低反应温度.
点评 本题主要考查的是平衡移动、电极反应式书写、电解池反应原理等,综合性较强,难度较大,注意整理归纳.

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案| A. | “低碳生活”是指生活中尽量使用含碳量较低的物质 | |
| B. | 燃煤中加入CaO后可减少酸雨的发生及温室气体的排放 | |
| C. | 纤维素在人体内可水解为葡萄糖,是人类重要的营养物质之一 | |
| D. | 鼓励汽车、家电“以旧换新”,可减少环境污染,发展循环经济,促进节能减排 |
| A. | 0.1 mol•L-1Ba(OH)2溶液中含有0.2nA个OH- | |
| B. | 1mol Na与足量水反应,转移2nA个电子 | |
| C. | 常温常压下,22.4L乙烯含有nA个CH2=CH2分子 | |
| D. | 常温常压下,46g NO2含有2nA个氧原子 |
| A. | 乙二醇和丙三醇是1:1 | B. | 乙醇和乙二醇是1:2 | ||
| C. | 甲醇和乙醇是5:1 | D. | 甲醇和乙醇是4:1 |
| A. | NH3$→_{催化剂}^{O_{2}}$NO$\stackrel{O_{2}•H_{2}O}{→}$HNO3 | |
| B. | 浓缩海水$\stackrel{CI_{2}}{→}$Br2$\stackrel{鼓入热空气}{→}$Br2(粗产品)$\stackrel{精制}{→}$Br2 | |
| C. | MnO2$→_{加热}^{浓HCI}$Cl2$\stackrel{Ca(OH)_{2}}{→}$漂白粉 | |
| D. | 石油$\stackrel{裂解}{→}$乙烯$→_{加热}^{催化剂}$聚乙烯 |
 某些金属与不同密度的硝酸反应时,往往生成多种不同价态的还原产物,如图是在相同条件下,各种不同密度的硝酸和铁反应时,还原产物的分布图.通过图象判断下列说法不正确的是( )
某些金属与不同密度的硝酸反应时,往往生成多种不同价态的还原产物,如图是在相同条件下,各种不同密度的硝酸和铁反应时,还原产物的分布图.通过图象判断下列说法不正确的是( )| A. | 稀硝酸与铁反应,一定有NO生成 | |
| B. | 密度小于1.1g•cm-3的硝酸与铁反应,还原产物百分率最多的是NH4+ | |
| C. | 某硝酸试剂瓶的标签注明:密度为1.26g•cm-3,质量分数50.0%;若取该试剂10ml配成100ml溶液,所得溶液pH=1 | |
| D. | 当硝酸的密度为1.36g•cm-3时,过量铁与硝酸反应,消耗的铁与被还原的硝酸物质的量之比为1:1 |
(1)F元素价层电子排布式为3d64s4.
(2)关于B2A2的下列说法中正确的是②④.
①B2A2中的所有原子都满足8电子稳定结构
②B2A2是由极性键和非极性键形成的非极性分子
③每个B2A2分子中σ键和π键数目比为1:1
④B2A2分子中的A-B键属于s-spσ键
(3)B、C、D三种元素第一电离能按由大到小的顺序排列为N>O>C(用元素符号表示).B、C、D三种元素中与BD2互为等电子体的分子式为N2O.(用元素符号表示)
(4)A2E分子中心原子的杂化类型为sp3.比较A2D与A2E分子的沸点,其中沸点较高的原因为H2O分子之间存在氢键.元素D可形成两种同素异形体,其中在水中溶解度更大的是O3(填分子式).
(5)F单质的晶体在不同温度下有两种堆积方式,信息如下:
| 序号 | 堆积方式 | 晶胞棱长(cm) |
| Ⅰ | 面心立方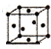 | a |
| Ⅱ | 体心立方 | b |
| A. | 最外层电子数:Z>R>Y | |
| B. | 气态氢化物的稳定性:Y>Z | |
| C. | R、X的氧化物均为离子化合物 | |
| D. | X和Y两者最高价氧化物对应的水化物能相互反应 |
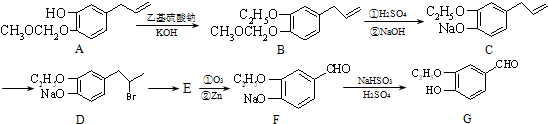
 .
.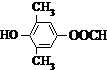 或
或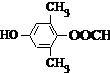 .
.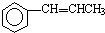 为原料制备
为原料制备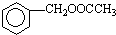 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br.