5.生活中的问题常涉及化学知识,下列过程不涉及化学变化的是( )
| A. | 用食醋除去暖瓶内的水垢 | B. | 鸡蛋白溶液遇硝酸变黄 | ||
| C. | 碘单质遇淀粉变蓝 | D. | 用汽油洗去衣物上的油污 |
3.下列溶液中,粒子的物质的量浓度关系正确的是( )
| A. | 0.1mol•L-1Na2SO3溶液中:c(OH-)=c(HSO3-)+c(H+)+c(H2SO3) | |
| B. | 1L0.1mol•L-1CuCl2溶液中:c(Cl-)=2c(Cu2+) | |
| C. | 物质的量浓度相等的Na2S和NaHS的混合溶液中:2c(Na+)=3c(S2-)+3c(HS-)+3c(H2S) | |
| D. | 室温时,向一定物质的量浓度的CH3COOH溶液中加入一定体积的氢氧化钠溶液,充分反应后溶液的pH=7,则反应后的溶液中:c(CH3COO-)>c(Na+)>c(H+)=c(OH-) |
2.关于过氧化物的叙述正确的是(NA表示阿伏加德罗常数)( )
| A. | 7.8g过氧化钠含有的共用电子对数为0.2NA | |
| B. | 2H2O2(l)=2H2O(l)+O2(g)△H=-98.2kJ•mol-1,△S=70.5J•mol-1•K-1该反应任意温度下都能自发进行 | |
| C. | 过氧化氢使高锰酸钾溶液褪色,1mol过氧化氢得到2NA电子 | |
| D. | 在含有NH4+、Ba2+、Cl-、NO3-离子的溶液中,加入少量过氧化钠以上各离子量几乎不减少 |
20.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 10mL 18mol/L浓硫酸与足量铜加热充分反应,转移电子数为0.18NA | |
| B. | 0.1mol24Mg32S晶体中所含中子总数为2.8NA | |
| C. | 标准状况下,22.4LCO2中含有的共同电子对数为2NA | |
| D. | 6.0g醋酸晶体中含有的H+数为0.1NA |
19.如图,铝电池(甲)性能优越,现用该电池给乙装置进行电解,以制备一种“绿色高效多功能”水处理剂,下列说法错误的是( )


| A. | 甲装置工作时,正极发生发应为3AgO+6e-+3H2O=3Ag+6OH-; | |
| B. | 若乙装置选用阴离子交换膜时,则电解完成后,右侧溶液中含有FeO42-; | |
| C. | 每制得1mol Na2FeO4,理论上甲装置中消耗2mol NaOH; | |
| D. | 乙装置若选用阴离子交换膜,电解一段时间后,右侧溶液PH下降(忽略溶液体积改变). |
16.甲醇是有机化工原料和优质燃料,主要应用于精细化工、塑料等领域,也是农药.医药的重要之一回答下列问题:
(1)工业上利用CO2和H2反应合成甲醇.已知25℃.101kPa下:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242kJ•mol-1
CH2OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H20(g)△H2=-676kJ•mol-1
①写出CO2和H2反应生成CH2OH(g)与H2O(g)的热化学方程式CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50kJ/mol
②下列表示该合成甲醇反应的能量变化示意图中正确的是a(填字母)

③合成甲醇所需的H2可由下列反应制取:H2O(g)+CO(g)=H2(g)+CO2(g),某温度下该反应的平衡常数K=1,若起始时c(CO)=1mol•L-1,c(H2O)=2mol•L-1,则达到平衡时H2O的转化率为33.3%
(2)CO和H2反应也能合成甲醇:CO(g)+2H2(g)=CH2OH(g)△H=-90.1kJ•mol-1,在250℃下,将一定量的CO和H2投入10L的恒容密闭容器中,各物质浓度(mol•L-1)变化如下表所示(前6min没有改变条件)
①x=0.14,250℃时该反应的平衡常数K=46.3
②若6~8min时只改变了一个条件,则改变的条件是增加了1 mol氢气,第8min时,该反应是否达到平衡状态?不是(填“是”或“不是”)
③该合成反应的温度一般控制在240~270℃,选择此温度的原因是:
Ⅰ.此温度下的催化剂活性;
Ⅱ温度低,反应速率慢,单位时间内的产量低;而该反应为放热反应,温度过高,转化率降低
(3)甲醇在催化剂条件下可以直接氧化成甲酸,在常温下,20.00mL,0.1000mol•L-1NaOH溶液与等体积、等浓度甲酸溶液混合后所得溶液的pH>7(填“<”“>”或“=”)原因是HCOO-+H2O?HCOOH+OH-(用离子方程式表示)
0 167278 167286 167292 167296 167302 167304 167308 167314 167316 167322 167328 167332 167334 167338 167344 167346 167352 167356 167358 167362 167364 167368 167370 167372 167373 167374 167376 167377 167378 167380 167382 167386 167388 167392 167394 167398 167404 167406 167412 167416 167418 167422 167428 167434 167436 167442 167446 167448 167454 167458 167464 167472 203614
(1)工业上利用CO2和H2反应合成甲醇.已知25℃.101kPa下:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242kJ•mol-1
CH2OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H20(g)△H2=-676kJ•mol-1
①写出CO2和H2反应生成CH2OH(g)与H2O(g)的热化学方程式CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50kJ/mol
②下列表示该合成甲醇反应的能量变化示意图中正确的是a(填字母)

③合成甲醇所需的H2可由下列反应制取:H2O(g)+CO(g)=H2(g)+CO2(g),某温度下该反应的平衡常数K=1,若起始时c(CO)=1mol•L-1,c(H2O)=2mol•L-1,则达到平衡时H2O的转化率为33.3%
(2)CO和H2反应也能合成甲醇:CO(g)+2H2(g)=CH2OH(g)△H=-90.1kJ•mol-1,在250℃下,将一定量的CO和H2投入10L的恒容密闭容器中,各物质浓度(mol•L-1)变化如下表所示(前6min没有改变条件)
| 2min | 4min | 6min | 8min | ′′′ | |
| CO | 0.07 | 0.06 | 0.04 | 0.05 | ′′′ |
| H2 | x | 0.12 | 0.12 | 0.2 | ′′′ |
| CH2OH | 0.03 | 0.04 | 0.04 | 0.05 | ′′′ |
②若6~8min时只改变了一个条件,则改变的条件是增加了1 mol氢气,第8min时,该反应是否达到平衡状态?不是(填“是”或“不是”)
③该合成反应的温度一般控制在240~270℃,选择此温度的原因是:
Ⅰ.此温度下的催化剂活性;
Ⅱ温度低,反应速率慢,单位时间内的产量低;而该反应为放热反应,温度过高,转化率降低
(3)甲醇在催化剂条件下可以直接氧化成甲酸,在常温下,20.00mL,0.1000mol•L-1NaOH溶液与等体积、等浓度甲酸溶液混合后所得溶液的pH>7(填“<”“>”或“=”)原因是HCOO-+H2O?HCOOH+OH-(用离子方程式表示)
 .
. 元素周期表可以指导我们寻找和合成成新的物质,如金属和非金属分界线附近的元素可用于制造半导体材料,是科学研究的热点
元素周期表可以指导我们寻找和合成成新的物质,如金属和非金属分界线附近的元素可用于制造半导体材料,是科学研究的热点 或
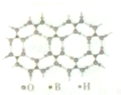
或 ,硼酸具有层状结构,每层结构如图所示,每摩尔晶体中所含氢键的数目为3NA(设NA为阿伏伽德罗常数的值)
,硼酸具有层状结构,每层结构如图所示,每摩尔晶体中所含氢键的数目为3NA(设NA为阿伏伽德罗常数的值)
