题目内容
2.关于过氧化物的叙述正确的是(NA表示阿伏加德罗常数)( )| A. | 7.8g过氧化钠含有的共用电子对数为0.2NA | |
| B. | 2H2O2(l)=2H2O(l)+O2(g)△H=-98.2kJ•mol-1,△S=70.5J•mol-1•K-1该反应任意温度下都能自发进行 | |
| C. | 过氧化氢使高锰酸钾溶液褪色,1mol过氧化氢得到2NA电子 | |
| D. | 在含有NH4+、Ba2+、Cl-、NO3-离子的溶液中,加入少量过氧化钠以上各离子量几乎不减少 |
分析 A.Na2O2是由钠离子和过氧根离子构成的,1molO22-中含有1mol共用电子对;
B.反应能否自发进行,决定于△H-T△S的大小,△H-T△S<0时反应能自发进行;
C.2KMnO4+3H2O2=2MnO2+2KOH+3O2↑+2H2O反应中中O元素从-1价升高到0价;
D.过氧化钠与水反应生成NaOH,强碱性溶液中铵根离子不能大量存在.
解答 解:A.Na2O2是由钠离子和过氧根离子构成的,1molO22-中含有1mol共用电子对,则7.8g过氧化钠即0.1mol,含有共用电子对为0.1NA,故A错误;
B.反应能否自发进行,决定于△H-T△S的大小,△H-T△S<0时反应能自发进行,已知△H=-98.2kJ•mol-1,△S=70.5J•mol-1•K-1,则△H-T△S=-98KJ/mol-[0.0705KJ/(mol•K)T]=-98KJ/mol-0.0705KJ/(mol•K)T,当T为任意值时,△H-T△S<0,反应在任意温下可以自发进行,故B正确;
C.2KMnO4+3H2O2=2MnO2+2KOH+3O2↑+2H2O反应中中O元素从-1价升高到0价,则1mol过氧化氢失去2NA电子,故C错误;
D.过氧化钠与水反应生成NaOH,强碱性溶液中铵根离子不能大量存在,则在含有NH4+、Ba2+、Cl-、NO3-离子的溶液中,加入少量过氧化钠,NH4+减少,故D错误.
故选B.
点评 本题考查了物质的量的有关计算、氧化还原反应、反应自发性的判断、离子共存,题目涉及的知识点较多,侧重于基础知识的综合应用的考查,题目难度中等.

练习册系列答案
相关题目
12.下列对化合物M、N的叙述正确的是( )


| A. | M的分子式为C12H9O3 | |
| B. | 1mol M在最多能与6molH2发生加成反应 | |
| C. | M与N可用试剂组合:溴水、NaOH溶液鉴别 | |
| D. | M与N可用试剂组合:FeCl3溶液、稀H2SO4鉴别 |
13.阿魏酸在食品、医药等方面有若干广泛用途.一种合成阿魏酸的反应可表示为
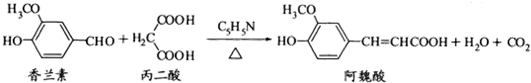
下列说法正确的是( )

下列说法正确的是( )
| A. | 可用酸性KMnO4溶液检测上述反应是否有阿魏酸生成 | |
| B. | 香兰素、阿魏酸均可与Na2CO3、NaOH、NaHCO3溶液反应 | |
| C. | 香兰素、阿魏酸都能发生取代、加成、消去反应 | |
| D. | 与香兰素互为同分异构体,分子中有4种不同化学环境的氢,且能发生银镜反应的酚类化合物共有2种 |
10.分类就是按照种类、等级或性质分别归类.依据不同的分类标准,结论也不尽相同.下列每组中有一种物质具有特殊的组成或性质,而其他两种物质的组成或性质相似.请你利用所学知识将其区分出来并说明理由.
| 化学式 | 被区分的物质(名称) | 理由 |
| Na2CO3、CaCO3、NaCl | NaCl | 由两种元素组成,或不含碳(或氧)元素 |
| C、CO2、H2CO3 | 碳 | 单质 |
7.化合物A、B、C、D各由两种元素组成,甲、乙、丙是短周期元素的三种单质.这些常见的化合物与单质之间存在如下关系(已知C是一种有机物),以下结论不正确的是( )
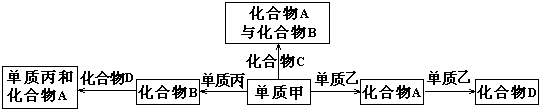

| A. | 常温下,甲、乙、丙三种单质均为气体 | |
| B. | 上述转化关系所涉及的化合物中有一种是电解质 | |
| C. | 上图所示的五个转化关系中,有三个是化合反应 | |
| D. | 上图所示的五个转化关系中,均为氧化还原反应 |
11.下列属于共价化合物的是( )
| A. | Cl2 | B. | NaOH | C. | CH4 | D. | (NH4)2SO4 |
12.一定条件下,将0.1LCO、0.2LCO2、0.1LNO、0.2LNO2和0.2LNH3混合,然后通过分别盛有足量蒸馏水、饱和碳酸氢钠溶液和氢氧化钠溶液的三个洗气瓶(洗气瓶排列顺序不确定).假设气体通过每个洗气瓶都能充分反应,则尾气(已干燥)( )
| A. | 可能是单一气体,也可能存在原气体中的两种气体 | |
| B. | 可能含有也可能不含一氧化碳 | |
| C. | 无论顺序如何,各瓶增重相同 | |
| D. | 成分和洗气瓶的排列顺序无关 |
