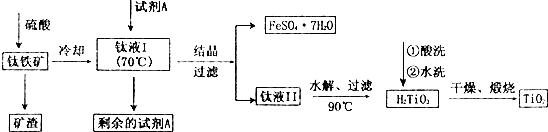
题目内容
1. 元素周期表可以指导我们寻找和合成成新的物质,如金属和非金属分界线附近的元素可用于制造半导体材料,是科学研究的热点
元素周期表可以指导我们寻找和合成成新的物质,如金属和非金属分界线附近的元素可用于制造半导体材料,是科学研究的热点(1)锗是一种重要的半导体材料,基态锗原子的价层电子排布图为4s24p2
(2)GaAs是人工合成的新型半导体材料,可将(CH3)2Ga和AsH3在700℃时反应得到,反应的化学方程式为(CH3)3Ga+AsH3$\frac{\underline{\;700℃\;}}{\;}$3CH4+GaAs,GaAs晶体结构与金刚石相似,晶体中Ga的杂化轨道类型为sp3,As与Ga之间存在的化学键有共价键
(3)元素As和Se中第一电离能较小的是硒(填元素名称);As2Se2是一种非晶态半导体,也称玻璃半导体,下列说法正确的是B(填选项序号)
A.固态As2Se2具有良好的自范性
B.固态As2Se2表现为各向同性
C.As2Se3属于合金
(4)硼酸三异丙酯为半导体硼扩散源,可由硼酸与醇酯化反应得到,硼酸(H2BO3)为一元弱酸,其呈酸性的机理是:硼酸与水作用时,硼原子与水电离产生的OH-结合形成Y-离子,导致溶液中c(H+)>c(OH-),Y-的结构简式是
 或
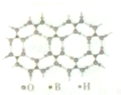
或 ,硼酸具有层状结构,每层结构如图所示,每摩尔晶体中所含氢键的数目为3NA(设NA为阿伏伽德罗常数的值)
,硼酸具有层状结构,每层结构如图所示,每摩尔晶体中所含氢键的数目为3NA(设NA为阿伏伽德罗常数的值)
分析 (1)锗为32号元素,根据构造原理书,基态锗原子核外电子排布式,然后确定价层电子排布图;
(2)根据反应物、生成物结合反应条件可书写化学方程式;金刚石中每个碳原子形成4个C-C键,所以C原子的杂化方式为sp3,原子和原子之间以共价键相结合,利用结构相似来解答;
(3)同一周期元素的第一电离能随着原子序数的增大呈增大趋势,注意第ⅤA族的大于第ⅥA族;晶体具有自范性、各向异性和固定的熔沸点;但晶体具有各向异性,多晶体和非晶体具有各向同性;合金中肯定含有金属元素;
(4)根据题目中的信息硼酸与水作用时,硼原子与水电离产生的OH-以配位键结合形成Y-离子来解答;由结构可知,一个H3BO3分子对应着6个氢键,一个氢键对应着2个H3BO3分子.
解答 解:(1)锗为32号元素,根据构造原理书,基态锗原子核外电子排布式:1s22s22p63s23p63d104s24p2,价层电子排布图为:4s24p2;
故答案为:4s24p2;
(2)反应物(CH3)3Ga和AsH3,生成物GaAs,根据质量守恒可知还应有CH4,反应的化学方程式为:(CH3)3Ga+AsH3$\frac{\underline{\;700℃\;}}{\;}$3CH4+GaAs;金刚石中每个碳原子形成4个C-C键,所以C原子的杂化方式为sp3,原子和原子之间以共价键相结合,而CaAs晶体结构与金刚石相似,晶体中Ca的杂化轨道类型为sp3,As与Ca之间存在的化学键有共价键;
故答案为:(CH3)3Ga+AsH3$\frac{\underline{\;700℃\;}}{\;}$3CH4+GaAs;sp3;共价键;
(3)同一周期元素的第一电离能随着原子序数的增大呈增大趋势,注意第ⅤA族的大于第ⅥA族,则元素As和Se中第一电离能较小的是Se;As2Se2是一种非晶态物质,所以不具有良好的自范性,不是合金,但具有各向同性;
故答案为:硒;B;
(4)硼酸与水作用,B(OH)3+H20? +H+;一个H3BO3分子对应着6个氢键,一个氢键对应着2个H3BO3分子,则1个H3BO3分子的晶体中有6×$\frac{1}{2}$=3个氢键,因此含有1molH3BO3分子的晶体中有3mol氢键;
+H+;一个H3BO3分子对应着6个氢键,一个氢键对应着2个H3BO3分子,则1个H3BO3分子的晶体中有6×$\frac{1}{2}$=3个氢键,因此含有1molH3BO3分子的晶体中有3mol氢键;
故答案为: 或
或 ;3NA.
;3NA.
点评 本题考查原子杂化、第一电离能、氢键的判断、原子核外电子排布等知识点,注重原子结构和性质的考查,难点是(4),注意每个分子形成氢键的个数.

 名校课堂系列答案
名校课堂系列答案| A. | 碘乙烷水解实验后,取水解液,加入AgNO3溶液,检验卤素离子 | |
| B. | 碘乙烷水解实验后,取水解液,加入KMnO4(H+)溶液,检验产物乙醇 | |
| C. | 碘乙烷消去实验后,将气体导入KMnO4(H+)溶液,检验产物乙烯 | |
| D. | 碘乙烷消去实验后,将气体导入Br2(CCl4)溶液,检验产物乙烯 |
| A. | 4种 | B. | 8种 | C. | 12种 | D. | 16种 |
(1)工业上利用CO2和H2反应合成甲醇.已知25℃.101kPa下:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242kJ•mol-1
CH2OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H20(g)△H2=-676kJ•mol-1
①写出CO2和H2反应生成CH2OH(g)与H2O(g)的热化学方程式CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50kJ/mol
②下列表示该合成甲醇反应的能量变化示意图中正确的是a(填字母)

③合成甲醇所需的H2可由下列反应制取:H2O(g)+CO(g)=H2(g)+CO2(g),某温度下该反应的平衡常数K=1,若起始时c(CO)=1mol•L-1,c(H2O)=2mol•L-1,则达到平衡时H2O的转化率为33.3%
(2)CO和H2反应也能合成甲醇:CO(g)+2H2(g)=CH2OH(g)△H=-90.1kJ•mol-1,在250℃下,将一定量的CO和H2投入10L的恒容密闭容器中,各物质浓度(mol•L-1)变化如下表所示(前6min没有改变条件)
| 2min | 4min | 6min | 8min | ′′′ | |
| CO | 0.07 | 0.06 | 0.04 | 0.05 | ′′′ |
| H2 | x | 0.12 | 0.12 | 0.2 | ′′′ |
| CH2OH | 0.03 | 0.04 | 0.04 | 0.05 | ′′′ |
②若6~8min时只改变了一个条件,则改变的条件是增加了1 mol氢气,第8min时,该反应是否达到平衡状态?不是(填“是”或“不是”)
③该合成反应的温度一般控制在240~270℃,选择此温度的原因是:
Ⅰ.此温度下的催化剂活性;
Ⅱ温度低,反应速率慢,单位时间内的产量低;而该反应为放热反应,温度过高,转化率降低
(3)甲醇在催化剂条件下可以直接氧化成甲酸,在常温下,20.00mL,0.1000mol•L-1NaOH溶液与等体积、等浓度甲酸溶液混合后所得溶液的pH>7(填“<”“>”或“=”)原因是HCOO-+H2O?HCOOH+OH-(用离子方程式表示)
| A. | $\frac{125a}{9V}$mol/L | B. | $\frac{125a}{18V}$mol/L | C. | $\frac{125a}{36V}$mol/L | D. | $\frac{125a}{54V}$mol/L |
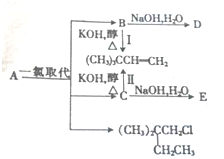 (1)A的分子式为C6H14,1molA完全燃烧消耗O29.5mol.
(1)A的分子式为C6H14,1molA完全燃烧消耗O29.5mol.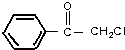
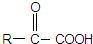
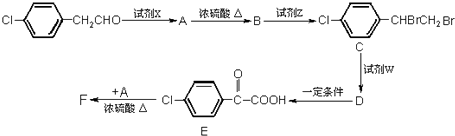
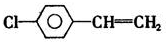 .
.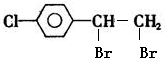 +2NaOH $→_{△}^{水}$
+2NaOH $→_{△}^{水}$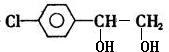 +2NaBr.
+2NaBr.