20.设NA为阿伏加德罗常数,则下列说法不正确的是( )
| A. | 0.1mol乙炔分子中含有的共用电子对数目为0.5NA | |
| B. | 常温常压,1.6g甲烷含有的质子数为NA | |
| C. | 14g乙烯和环丙烷混合物中含有的碳原子数目为NA | |
| D. | 在标准状态下,2.24L己烷含有的氢原子数目为1.4NA |
17.已知乙炔(C2H2)、苯(C6H6)、乙醛(C2H4O)的混合气体中含氧元素的质量分数为8%,则混合气体中碳元素的质量分数为( )
| A. | 60% | B. | 84% | C. | 42% | D. | 无法计算 |
16.下列说法正确的是( )
| A. | 分子式为C3H6与C6H12的两种有机物一定互为同系物 | |
| B. | 具有相同通式CnH2n+2的有机物不一定互为同系物 | |
| C. | 两个相邻同系物的分子量数值一定相差14 | |
| D. | 分子组成相差一个或几个CH2原子团的化合物必定互为同系物 |
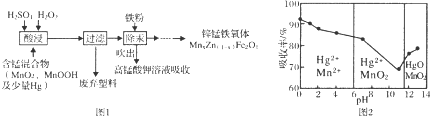
15.在实验室里可用如图1所示装置制取氯酸钾、次氯酸钠和探究氯水的性质.
图1中:①为氯气发生装置;②的试管里盛有15mL 30% KOH溶液,并置于水浴中;③的试管里盛有15mL 8% NaOH溶液,并置于冰水浴中;④的试管里盛有紫色石蕊溶液.
请回答下列问题:
(1)仪器a的名称是锥形瓶.
(2)实验室制取氯气的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.为了除去氯气中的氯化氢气体,可在①与②之间安装盛有B(填字母代号)的净化装置.
A.碱石灰B.饱和食盐水C.浓硫酸D.饱和碳酸氢钠溶液
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是制取温度不同、制取时碱的浓度也不同.反应完毕经冷却后,②的试管中有大量晶体析出.在图2中符合该晶体溶解度曲线的是M(填字母代号);从②的试管中分离出晶体的操作是过滤,该操作需要用到的玻璃仪器有普通漏斗、玻璃棒、烧杯.
(4)次氯酸钠中存在的化学键类型为离子键、共价键.
(5)实验中可观察到④的试管里溶液的颜色发生了如下变化,请完成下表中的空白:
(6)装置⑤的作用是吸收尾气,防止污染.

图1中:①为氯气发生装置;②的试管里盛有15mL 30% KOH溶液,并置于水浴中;③的试管里盛有15mL 8% NaOH溶液,并置于冰水浴中;④的试管里盛有紫色石蕊溶液.
请回答下列问题:
(1)仪器a的名称是锥形瓶.
(2)实验室制取氯气的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.为了除去氯气中的氯化氢气体,可在①与②之间安装盛有B(填字母代号)的净化装置.
A.碱石灰B.饱和食盐水C.浓硫酸D.饱和碳酸氢钠溶液
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是制取温度不同、制取时碱的浓度也不同.反应完毕经冷却后,②的试管中有大量晶体析出.在图2中符合该晶体溶解度曲线的是M(填字母代号);从②的试管中分离出晶体的操作是过滤,该操作需要用到的玻璃仪器有普通漏斗、玻璃棒、烧杯.
(4)次氯酸钠中存在的化学键类型为离子键、共价键.
(5)实验中可观察到④的试管里溶液的颜色发生了如下变化,请完成下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成的HClO将石蕊氧化为无色物质 |
| 然后溶液从无色逐渐变为浅黄绿色色 | 继续通入的氯气溶于水使溶液呈浅黄绿色 |
14.以下有关原子结构及元素周期律的叙述中正确的是( )
| A. | 同种元素的原子均有相同的质子数和中子数 | |
| B. | 同主族元素的简单阴离子还原性越强,水解程度越大 | |
| C. | 同周期金属元素的化合价越高,其原子失电子能力越强 | |
| D. | 短周期第ⅣA与ⅦA族元素的原子间构成的分子,均满足原子最外层8电子结构 |
11.测得苯、乙醛、乙二醇、乙酸乙酯的混合物中含碳量为66.0%,则该混合物中含氧量为( )
0 167252 167260 167266 167270 167276 167278 167282 167288 167290 167296 167302 167306 167308 167312 167318 167320 167326 167330 167332 167336 167338 167342 167344 167346 167347 167348 167350 167351 167352 167354 167356 167360 167362 167366 167368 167372 167378 167380 167386 167390 167392 167396 167402 167408 167410 167416 167420 167422 167428 167432 167438 167446 203614
| A. | 30.8% | B. | 28.6% | C. | 25.3% | D. | 22.7% |
 .
.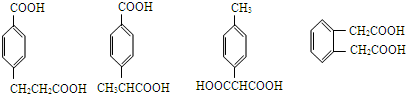 任意一种.
任意一种.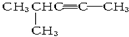 分子式为C6H10,以系统命名法命名的名称是4-甲基-2-戊炔,1mol该烃完全燃烧耗O28.5 mol.
分子式为C6H10,以系统命名法命名的名称是4-甲基-2-戊炔,1mol该烃完全燃烧耗O28.5 mol.