题目内容
14.以下有关原子结构及元素周期律的叙述中正确的是( )| A. | 同种元素的原子均有相同的质子数和中子数 | |
| B. | 同主族元素的简单阴离子还原性越强,水解程度越大 | |
| C. | 同周期金属元素的化合价越高,其原子失电子能力越强 | |
| D. | 短周期第ⅣA与ⅦA族元素的原子间构成的分子,均满足原子最外层8电子结构 |
分析 A、同种元素的不同核素质子数相同,中子数不同;
B、同主族元素的简单阴离子还原性越强,越难水解;
C、同周期金属元素的化合价越高,越难失去电子;
D、短周期第ⅣA与ⅦA族元素的原子间构成的分子,化合物为XY4型,共价键数+原子最外层电子数=8满足8电子.
解答 解;A、同种元素的不同核素质子数相同,中子数不同,故A错误;
B、同主族元素的简单阴离子还原性越强,越难水解,如卤族元素中,碘离子还原性最强,不水解,故B错误;
C、同周期金属元素的化合价越高,越难失去电子,如第三周期中,Na比Al容易失去电子,故C错误;
D、ⅣA(用X表示)与ⅦA(用Y表示)形成的化合物为XY4,X形成四个键,加上原来的4个电子,最外层共8个电子,每个Y形成一个键,加上原来的7个电子,共8个电子,故D正确.
故选:D.
点评 本题考查元素周期表和元素周期律的应用,注意同周期、同主族元素的性质变化规律是解答本题的关键,注意利用实例分析问题,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列说法正确的是( )
①含共价键的化合物一定是共价化合物
②气态单质分子中一定含有共价键
③由非金属元素组成的化合物可能是离子化合物
④离子化合物中一定含有离子键
⑤由不同元素组成的多原子分子里,一定只存在极性共价键.
①含共价键的化合物一定是共价化合物
②气态单质分子中一定含有共价键
③由非金属元素组成的化合物可能是离子化合物
④离子化合物中一定含有离子键
⑤由不同元素组成的多原子分子里,一定只存在极性共价键.
| A. | ②③ | B. | ②③⑤ | C. | ③④ | D. | ①②④ |
5.在实验室里,下列除去杂质的方法正确的是( )
①溴苯中混有溴:加入KI溶液,用汽油萃取出溴;
②除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离;
③硝基苯中混有浓硝酸和浓硫酸:将其倒入浓烧碱溶液中,静置,然后分液;
④乙烯中混有CO2:将其通入浓氢氧化钠溶液洗气后干燥;
⑤除去乙醇中少量的乙酸:加足量生石灰,蒸馏.
①溴苯中混有溴:加入KI溶液,用汽油萃取出溴;
②除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离;
③硝基苯中混有浓硝酸和浓硫酸:将其倒入浓烧碱溶液中,静置,然后分液;
④乙烯中混有CO2:将其通入浓氢氧化钠溶液洗气后干燥;
⑤除去乙醇中少量的乙酸:加足量生石灰,蒸馏.
| A. | ①③⑤ | B. | ②③⑤ | C. | ①④⑤ | D. | ③④⑤ |
2.已知阴离子R2-的原子核内有x个中子,R原子的质量数为m,则WgR原子完全转化为R2-时,含有电子的物质的量是( )
| A. | $\frac{m-x-2}{W-m}$ mol | B. | $\frac{W(m-x)}{m}$ mol | C. | $\frac{W(m-x-2)}{m}$mol | D. | $\frac{W(m-x+2)}{m}$ mol |
9.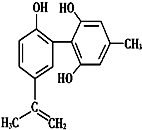 奥运会中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中正确的是( )
奥运会中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中正确的是( )
 奥运会中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中正确的是( )
奥运会中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中正确的是( )| A. | 该物质与苯酚属于同系物 | |
| B. | 该物质不能使酸性KMnO4溶液褪色 | |
| C. | 1 mol该物质与浓溴水反应时最多消耗Br2为4 mol | |
| D. | 该分子中的所有原子共平面 |
6.某元素的原子核外有三个电子层,最外层有b个电子,下列对该元素的叙述正确的是( )
| A. | 该元素原子核内质子数为8+b | |
| B. | b≥4时形成的单质均为绝缘体 | |
| C. | 随着b数字的增大(b<8),元素的原子半径逐渐减小 | |
| D. | 随着b数字的增大,元素单质的还原性增强 |
3.分类是学习和研究化学的一种重要方法,下列分类不合理的是( )
| A. | K2CO3和CaSO4都属于盐 | B. | H2SO4和HNO3都属于酸 | ||
| C. | KOH和Fe(OH)3都属于碱 | D. | Na2O和Na2SiO3都属于氧化物 |
 .
. 任意一种.
任意一种.