题目内容
12.氨在工业上有很多重要应用,合成氨的流程示意图如下: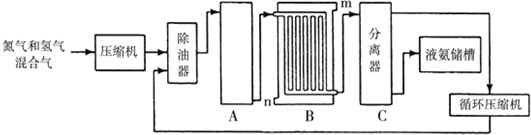
回答下列问题:
(1)设备A中含有电加热器、触煤和热交换器,设备A的名称合成塔,其中发生的化学反应方程式为N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3;原料氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学反应方程式:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2、CH4+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2;
(2)设备B的名称冷凝器,其中m和n是两个通水口,入水口是n(填“m”或“n”).不宜从相反方向通水的原因高温气体从冷凝塔上端进入,冷却水从下端进入,逆向冷凝效果更好;
(3)设备C的作用是将液氨和未反应的原料气体分离.
分析 (1)氮气和氢气在合成塔内发生化合反应生成氨气;利用碳或甲烷和水蒸气在高温下反应生成氢气和一氧化碳;
(2)从A中出来的混合气体进入冷却塔冷凝,为了达到最佳冷凝效果,高温气体从冷凝塔上端进入,冷却水从下端进入;
(3)C是分离塔,在分离塔内将液氨和未反应的原料气体分离,原料可循环利用.
解答 解:(1)氮气和氢气在合成塔内发生化合反应生成氨气方程式为:N2+3H2 $\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3;碳和水蒸气反应方程式:C+H2O $\frac{\underline{\;高温\;}}{\;}$ CO+H2;甲烷和水蒸气反应方程式:CH4+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2,
故答案为:合成塔;N2+3H2 $\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3;C+H2O $\frac{\underline{\;高温\;}}{\;}$ CO+H2、CH4+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2;
(2)混合气体进入冷却塔冷凝,冷凝水从下口n进入,从上口m排出,这样通过逆向通水,冷凝效果会更好,
故答案为:冷凝器;n;高温气体从冷凝塔上端进入,冷却水从下端进入,逆向冷凝效果更好;
(3)C是分离塔,在分离塔内将液氨和未反应的原料气体分离,然后循环利用,提高了原料的利用率,
故答案为:将液氨和未反应的原料气体分离.
点评 本题考查了工业合成氨的流程,题目难度中等,明确合成原理为解答关键,注意掌握工业合成氨的流程及装置名称,要求学生能够正确书写常见反应的化学方程式.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
2.下列物质中属于共价化合物的是( )
| A. | Cl2 | B. | NH4Cl | C. | HCl | D. | NaOH |
3.下表是A、B、C、D、E五种有机物的有关信息:
回答下列问题:
(1)A~E中,属于烃的是AB(填字母).
(2)有机物B具有的性质是②③ (填序号).
①无色无味的液体;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色
(3)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br,反应类型为加成反应.
(4)写出D生成A的化学方程式CH3CH2Cl+NaOH$→_{△}^{乙醇}$CH2=CH2+NaCl+H2O反应类型为消去反应.
(5)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是2CH3COOH+Na2CO3=2CH3COONa+CO2↑+H2O(用化学方程式说明).
| A | ①能使溴的四氯化碳溶液褪色; ②比例模型为  ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成. ②球棍模型为 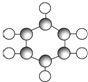 |
| C | ①由C、H、O三种元素组成; ②能与Na反应; ③与E反应生成乙酸乙酯 |
| D | ①由C与HCl浓溶液取代反应生成; ②在不同条件下,D能生成A,也能生成C |
| E | ①由C、H、O三种元素组成; ②其水溶液能使紫色石蕊试液变红 |
(1)A~E中,属于烃的是AB(填字母).
(2)有机物B具有的性质是②③ (填序号).
①无色无味的液体;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色
(3)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br,反应类型为加成反应.
(4)写出D生成A的化学方程式CH3CH2Cl+NaOH$→_{△}^{乙醇}$CH2=CH2+NaCl+H2O反应类型为消去反应.
(5)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是2CH3COOH+Na2CO3=2CH3COONa+CO2↑+H2O(用化学方程式说明).
7.为把溴水中溴单质萃取出来,下列物质可达到目的是( )
| A. | 乙醇 | B. | 苯酚溶液 | C. | 直馏汽油 | D. | 乙酸 |
17.已知乙炔(C2H2)、苯(C6H6)、乙醛(C2H4O)的混合气体中含氧元素的质量分数为8%,则混合气体中碳元素的质量分数为( )
| A. | 60% | B. | 84% | C. | 42% | D. | 无法计算 |
1.下列物质中既含极性共价键又含有离子键的是( )
| A. | Na2O2 | B. | KCl | C. | HCl | D. | K2SO4 |
 一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:
一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答: