题目内容
20.设NA为阿伏加德罗常数,则下列说法不正确的是( )| A. | 0.1mol乙炔分子中含有的共用电子对数目为0.5NA | |
| B. | 常温常压,1.6g甲烷含有的质子数为NA | |
| C. | 14g乙烯和环丙烷混合物中含有的碳原子数目为NA | |
| D. | 在标准状态下,2.24L己烷含有的氢原子数目为1.4NA |
分析 A、1mol乙炔中含5mol共用电子对;
B、求出甲烷的物质的量,而甲烷是10质子分子分析;
C、乙烯和环丙烷的最简式均为CH2来计算;
D、标况下,己烷为液态.
解答 解:A、1mol乙炔中含5mol共用电子对,故0.1mol乙炔中含0.5mol共用电子对,故A正确;
B、1.6g甲烷的物质的量n=$\frac{1.6g}{16g/mol}$=0.1mol,而甲烷是10电子,故1mol甲烷含10mol质子,则0.1mol甲烷含1mol质子,故B正确;
C、乙烯和环丙烷的最简式均为CH2,故14g混合物中含有的CH2的物质的量为1mol,故含1mol碳原子,故C正确;
D、标况下,己烷为液态,故不能用气体摩尔体积来计算,故D错误.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
10.某元素的最高价含氧酸的化学式为HnXO2n,则X元素的气态氢化物的化学式为( )
| A. | XH3n | B. | HX | C. | XH2n | D. | H8-3nX |
11.下列物质的性质比较,正确的是( )
| A. | 酸性:H2SO4>HClO4>HBrO4 | B. | 碱性:RbOH>KOH>NaOH | ||
| C. | 非金属性:P>S>Cl | D. | 气态氢化物稳定性:HF>HCl>H2S |
8.有机物的种类繁多,但其命名中是有规则的.下列有机物命名正确的是( )
| A. | CH3(CH2)4CH3 1,4-二甲基丁烷 | |
| B. | CH3CH(CH3)CH=CH2 甲基丁烯 | |
| C. | CH3CH2CH(CH3) CH2OH 2-甲基-1-丁醇 | |
| D. | CH2ClCH2Cl 二氯乙烷 |
15.在实验室里可用如图1所示装置制取氯酸钾、次氯酸钠和探究氯水的性质.
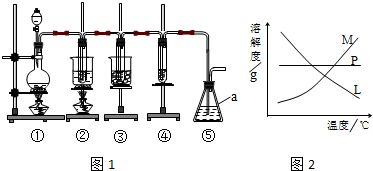
图1中:①为氯气发生装置;②的试管里盛有15mL 30% KOH溶液,并置于水浴中;③的试管里盛有15mL 8% NaOH溶液,并置于冰水浴中;④的试管里盛有紫色石蕊溶液.
请回答下列问题:
(1)仪器a的名称是锥形瓶.
(2)实验室制取氯气的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.为了除去氯气中的氯化氢气体,可在①与②之间安装盛有B(填字母代号)的净化装置.
A.碱石灰B.饱和食盐水C.浓硫酸D.饱和碳酸氢钠溶液
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是制取温度不同、制取时碱的浓度也不同.反应完毕经冷却后,②的试管中有大量晶体析出.在图2中符合该晶体溶解度曲线的是M(填字母代号);从②的试管中分离出晶体的操作是过滤,该操作需要用到的玻璃仪器有普通漏斗、玻璃棒、烧杯.
(4)次氯酸钠中存在的化学键类型为离子键、共价键.
(5)实验中可观察到④的试管里溶液的颜色发生了如下变化,请完成下表中的空白:
(6)装置⑤的作用是吸收尾气,防止污染.

图1中:①为氯气发生装置;②的试管里盛有15mL 30% KOH溶液,并置于水浴中;③的试管里盛有15mL 8% NaOH溶液,并置于冰水浴中;④的试管里盛有紫色石蕊溶液.
请回答下列问题:
(1)仪器a的名称是锥形瓶.
(2)实验室制取氯气的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.为了除去氯气中的氯化氢气体,可在①与②之间安装盛有B(填字母代号)的净化装置.
A.碱石灰B.饱和食盐水C.浓硫酸D.饱和碳酸氢钠溶液
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是制取温度不同、制取时碱的浓度也不同.反应完毕经冷却后,②的试管中有大量晶体析出.在图2中符合该晶体溶解度曲线的是M(填字母代号);从②的试管中分离出晶体的操作是过滤,该操作需要用到的玻璃仪器有普通漏斗、玻璃棒、烧杯.
(4)次氯酸钠中存在的化学键类型为离子键、共价键.
(5)实验中可观察到④的试管里溶液的颜色发生了如下变化,请完成下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成的HClO将石蕊氧化为无色物质 |
| 然后溶液从无色逐渐变为浅黄绿色色 | 继续通入的氯气溶于水使溶液呈浅黄绿色 |
12.下列说法不正确的是( )
| A. | CH3-CH=CH2和CH2=CH2的最简式相同 | |
| B. | CH≡CH和C6H6含碳量相同 | |
| C. | 乙炔和苯互为同系物 | |
| D. | 正戊烷、异戊烷、新戊烷的沸点逐渐降低 |
9.NaOH+HCl=NaCl+H2O,则40gNaOH完全反应所生成的水的质量为( )
| A. | 9g | B. | 18g | C. | 27g | D. | 26g |