题目内容
11.测得苯、乙醛、乙二醇、乙酸乙酯的混合物中含碳量为66.0%,则该混合物中含氧量为( )| A. | 30.8% | B. | 28.6% | C. | 25.3% | D. | 22.7% |
分析 苯的分子式为C6H6,乙醛分子式为C2H4O,改写为C2H2•H2O,乙二醇的分子式为C2H6O2,改写为C2H2•2H2O,乙酸乙酯的分子式为C4H8O2,改写C4H4•2H2O,而C2H2、C6H6、C4H4的最简式都是CH,进一步将混合物看作CH、H2O的混合物,根据碳元素的质量百分含量可计算出CH的质量分数,进而计算的水质量分数,再根据水的化学式计算氧元素的质量百分含量.
解答 解:苯的分子式为C6H6,乙醛分子式为C2H4O,改写为C2H2•H2O,乙二醇的分子式为C2H6O2,改写为C2H2•2H2O,乙酸乙酯的分子式为C4H8O2,改写C4H4•2H2O,而C2H2、C6H6、C4H4的最简式都是CH,进一步将混合物看作CH、H2O的混合物,碳元素的质量分数为66%,则w(CH)=$\frac{66%}{\frac{12}{13}}$=71.5%,故水的质量分数=1-71.5%=28.5%,则混合物中氧元素质量分数=28.5%×$\frac{16}{18}$=25.3%,故选C.
点评 本题考查混合物中元素质量分数计算,关键利用分子式的改写将混合物中C及部分H元素出现固定组成,将四组分混合物转化为两组分混合进行计算,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.有一种星际分子,其分子结构模型如图所示(图中球与球之间的连线代表化学键,如单键、双键、三键等,不同花纹的球表示不同的原子).对该物质判断正确的是( )
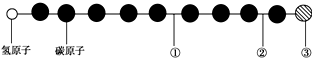

| A. | ①处的化学键是碳碳双键 | B. | ②处的化学键是碳碳三键 | ||
| C. | ③处的原子可能是氯原子或氟原子 | D. | ②处的化学键是碳碳单键 |
6.有关化学用语正确的是( )
| A. | 乙烯的最简式C2H4 | B. | 丙酮的分子式C3H6O | ||
| C. | 四氯化碳的电子式为: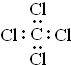 | D. | 乙醇的结构简式C2H6O |
16.下列说法正确的是( )
| A. | 分子式为C3H6与C6H12的两种有机物一定互为同系物 | |
| B. | 具有相同通式CnH2n+2的有机物不一定互为同系物 | |
| C. | 两个相邻同系物的分子量数值一定相差14 | |
| D. | 分子组成相差一个或几个CH2原子团的化合物必定互为同系物 |
20.合金具有优良的机械性能,用途广泛.下列物质不属于合金的是( )
| A. | 黄铜 | B. | 不锈钢 | C. | 紫铜 | D. | 生铁 |
1.可逆反应A+3B?2C+2D(各物质均为气体)在不同条件下测得的下列4种反应速率,其中反应最快的是( )
| A. | υD=0.4mol/(L•s) | B. | υC=0.5mol/(L•s) | C. | υB=0.6mol/(L•s) | D. | υA=0.22mol/(L•s) |
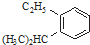 的炔烃的结构简式
的炔烃的结构简式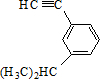 ;
; ;
;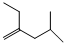 .
.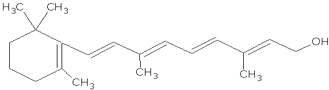 1mol维生素A最多能与5mol溴发生加成反应.
1mol维生素A最多能与5mol溴发生加成反应.