4. 研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
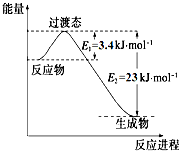
(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸汽和水蒸气.如图表示恒压容器中0.5mol CO2和1.5mol H2转化率达80%时的能量变化示意图. 能判断该反应达到化学平衡状态的依据是bd.
a.容器中压强不变
b.H2的体积分数不变c.
c(H2)=3c(CH3OH)
d.容中密度不变
e.2个C=O断裂的同时有6个H-H断裂.
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①实验2条件下平衡常数K=0.17.
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值<1(填具体值或取值范围).
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V正<V逆(填“<”,“>”,“=”).
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol.
(4)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性.常温下,向10mL 0.01mol•L-1 H2C2O4溶液中滴加10mL 0.01mol•L-1NaOH溶液时,比较溶液中各种离子浓度的大小关系c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(5)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池的负极反应式为CH3OCH3+16OH--12e-=2CO32-+11H2O.
 研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸汽和水蒸气.如图表示恒压容器中0.5mol CO2和1.5mol H2转化率达80%时的能量变化示意图. 能判断该反应达到化学平衡状态的依据是bd.
a.容器中压强不变
b.H2的体积分数不变c.
c(H2)=3c(CH3OH)
d.容中密度不变
e.2个C=O断裂的同时有6个H-H断裂.
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组[ | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值<1(填具体值或取值范围).
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V正<V逆(填“<”,“>”,“=”).
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol.
(4)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性.常温下,向10mL 0.01mol•L-1 H2C2O4溶液中滴加10mL 0.01mol•L-1NaOH溶液时,比较溶液中各种离子浓度的大小关系c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(5)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池的负极反应式为CH3OCH3+16OH--12e-=2CO32-+11H2O.
2.在一定条件下,可逆反应2A(气)+B(气)?nC(固)+D(气)达平衡.若维持温度不变,增大压强,测得混合气体的平均相对分子质量不发生改变,则下列说法正确的是( )
| A. | 其他条件不变,增大压强,平衡不发生移动 | |
| B. | 其他条件不变,增大压强,混合气体的总质量不变 | |
| C. | 该反应式中n值一定为2 | |
| D. | 原混合气体中A与B的物质的量之比为2:1,且2M(A)+M(B)=3M(D)(其中M表示物质的摩尔质量) |
1.下列选项中,离子方程式书写正确的是( )
| A. | 向Fe(NO3)2和KI混合溶液中加入少量稀盐酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ | |
| B. | 泡沫灭火器的灭火原理:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ | |
| C. | 向硝酸银溶液中加入足量的氨水:Ag++2NH3•H2O=Ag(NH3)2++2H2O | |
| D. | 用足量的氨水处理硫酸工业的尾气:SO2+NH3•H2O=NH4++HSO3- |
20.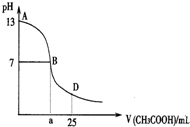 下图为向25mL 0.1mol•L-1 NaOH溶液中逐滴滴加0.2mol•L-1CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与
下图为向25mL 0.1mol•L-1 NaOH溶液中逐滴滴加0.2mol•L-1CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与
c(CH3COO-)大小关系是( )
 下图为向25mL 0.1mol•L-1 NaOH溶液中逐滴滴加0.2mol•L-1CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与
下图为向25mL 0.1mol•L-1 NaOH溶液中逐滴滴加0.2mol•L-1CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是( )
| A. | c(OH-)一定大于c(CH3COO-) | B. | c(OH-)一定小于c(CH3COO-) | ||
| C. | c(OH-)一定等于c(CH3COO-) | D. | c(OH-)大于、小于或等于c(CH3COO-) |
19.在环境保护、资源利用等与社会可持续发展密切相关的领域化学发挥着积极作用.下列做法与此理念相违背的是( )
0 167217 167225 167231 167235 167241 167243 167247 167253 167255 167261 167267 167271 167273 167277 167283 167285 167291 167295 167297 167301 167303 167307 167309 167311 167312 167313 167315 167316 167317 167319 167321 167325 167327 167331 167333 167337 167343 167345 167351 167355 167357 167361 167367 167373 167375 167381 167385 167387 167393 167397 167403 167411 203614
| A. | 食品中大量添加苯甲酸钠等防腐剂,可有效延长其保质期 | |
| B. | “地沟油”可以制成肥皂,提高资源的利用率 | |
| C. | 加快开发高效洁净能源转换技术,缓解能源危机 | |
| D. | “A PEC蓝”是2014年新的网络词汇,形容2014年A PEC会议期间北京蓝蓝的天空.说明京津冀实施道路限行和污染企业停工等措施,对减轻雾霾、保证空气质量是有效的 |
 碳元素是构成有机物的基础元素.
碳元素是构成有机物的基础元素. 双氧水是一种对环境友好的消毒剂、漂白剂,广泛应用于化工、医药、环保等领域.请回答下列问题:
双氧水是一种对环境友好的消毒剂、漂白剂,广泛应用于化工、医药、环保等领域.请回答下列问题: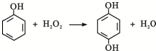 .
.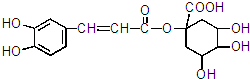 所示:
所示: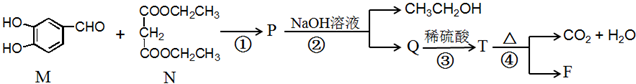

 .
.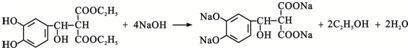 .
. .
.