题目内容
20.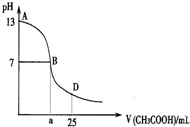 下图为向25mL 0.1mol•L-1 NaOH溶液中逐滴滴加0.2mol•L-1CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与
下图为向25mL 0.1mol•L-1 NaOH溶液中逐滴滴加0.2mol•L-1CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是( )
| A. | c(OH-)一定大于c(CH3COO-) | B. | c(OH-)一定小于c(CH3COO-) | ||
| C. | c(OH-)一定等于c(CH3COO-) | D. | c(OH-)大于、小于或等于c(CH3COO-) |
分析 AB区间内,包括CH3COOH和NaOH恰好完全反应以及CH3COOH不足,氢氧化钠溶液过量溶液显碱性两种可能性,在AB区间内,c(OH-)>c(H-),说明溶液显碱性,当NaOH和CH3COOH恰好反应时,显碱性,此时生成的溶液可能为醋酸钠,c(OH-)小于c(CH3COO-);当NaOH和CH3COOH反应后剩余NaOH,溶液仍然显碱性,此时若剩余的NaOH量很大,则c(OH-)大于c(CH3COO-).
解答 解:在AB区间内,c(OH-)>c(H-),说明溶液显碱性,当NaOH和CH3COOH恰好反应时,显碱性,此时生成的溶液可能为醋酸钠,c(OH-)小于c(CH3COO-);当NaOH和CH3COOH反应后剩余NaOH,溶液仍然显碱性,此时若剩余的NaOH量很大,则c(OH-)大于c(CH3COO-),也有可能剩余的NaOH和CH3COONa中CH3COO-水解之后剩余的CH3COO-的浓度相等;
故选:D.
点评 本题主要考查了中和滴定操作以及溶液中PH的计算,难度不大,根据课本知识可完成,难度中等.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
10.下列相关实验的描述正确的是( )
| A. | 可用CCl4萃取碘酒中的碘 | |
| B. | 做焰色反应实验时,透过蓝色钴玻璃,观察到火焰颜色为紫色,证明被检验物为一定为钾盐 | |
| C. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上2%~5%的硼酸溶液 | |
| D. | 室温下,浓度为0.1mol•L-1Na2S2O3和H2SO4溶液,分别取5mL与10mL混合,10mL与10mL混合,可验证Na2S2O3浓度对反应速率的影响 |
11.下列的反应的离子方程式书写正确的是( )
| A. | 向银氨溶液中加入盐酸:[Ag(NH3)2]++OH-+3H+=Ag++2NH4++H2O | |
| B. | 在少量Mg(OH)2悬浊液中加入氯化铵浓溶液:Mg(OH)2+2NH4+=2NH3•H2O+Mg2+ | |
| C. | 向硫酸铁溶液中加入硫化钠溶液:2Fe3++3S2-+6H2O=2Fe(OH)3↓+3H2S↑ | |
| D. | NaHCO3溶液和少量Ba(OH)2溶液混合:HCO3-+OH-+Ba2+=H2O+BaCO3↓ |
8.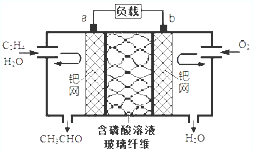 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,下列说法正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,下列说法正确的是( )
 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,下列说法正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,下列说法正确的是( )| A. | 每有0.1mol O2反应,则迁移H+0.4mol | |
| B. | 正极反应式为:CH2=CH2-2e-+2OH-=CH3CHO+H2O | |
| C. | 电子移动方向:电极a→磷酸溶液→电极b | |
| D. | 该电池为可充电电池 |
12.碱性电池有容量大,放电电流大的特点,被广泛应用.锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn+2MnO2+H2O=Zn(OH)2+Mn2O3.下列说法错误的是( )
| A. | 电池工作时,锌失去电子 | |
| B. | 电池正极的电极反应式为2MnO2+H2O+2e-═Mn2O3+2OH- | |
| C. | 外电路中每通过0.2mol电子,锌的质量理论上减少13g | |
| D. | 电池工作时,电子由负极通过外电路流向正极 |
9.下列说法正确的是( )
| A. | 厨房中用的食盐、食醋都是电解质 | |
| B. | 古代的陶瓷、砖瓦、现代的玻璃、水泥等,都是硅酸盐产品 | |
| C. | 石油的分馏、煤的干馏、石油的裂解都是化学变化 | |
| D. | 工业上通过电解熔融的氯化物制取Na、Mg、Al三种金属 |
10.加入铝粉有氢气产生的溶液中,可能大量共存的离子组是( )
| A. | Ba2+、Na+、I-、Fe3+ | B. | Mg2+、Cl-、NO3-、Al3+ | ||
| C. | K+、Cl-、HCO3-、SO42- | D. | Ba2+、Na+、Cl-、[Al(OH)4]- |
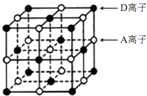 A、B、C、D为短周期主族元素,原子序数依次增大.A和D可形成化合物E,E的焰色反应呈黄色;B是地壳中含量最高的金属元素;C基态原子最外层原子轨道中有两个未成对电子且无空轨道.请回答下列问题:
A、B、C、D为短周期主族元素,原子序数依次增大.A和D可形成化合物E,E的焰色反应呈黄色;B是地壳中含量最高的金属元素;C基态原子最外层原子轨道中有两个未成对电子且无空轨道.请回答下列问题: