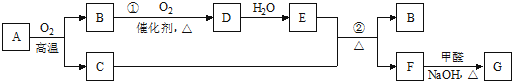
题目内容
17. 双氧水是一种对环境友好的消毒剂、漂白剂,广泛应用于化工、医药、环保等领域.请回答下列问题:
双氧水是一种对环境友好的消毒剂、漂白剂,广泛应用于化工、医药、环保等领域.请回答下列问题:(1)H2O2的结构式是H-O-O-H.
(2)双氧水能用作消毒剂,主要是利用它的B(填字母编号).
A.酸性 B.氧化性 C.还原性
(3)在硫酸作用下,利用H2O2可以准备ClO2.配平下列离子方程式:
2ClO3-+2H++1H2O2═1O2↑+2ClO2+2H2O
(4)通过如图的原电池装置可制备出HO2-(HO2-酸化后得到H2O2).该装置的负极是a①a(填“a”或“b”),正极的电极反应式是O2+H2O+2e-=HO2-+OH-②O2+H2O+2e-=HO2-+OH-.
(5)废水中的HCHO经H2O2处理后转化为H2O和CO2.已知HCHO和H2O2的起始浓度分别为0.05mol/L和0.15mol/L,10min时,测得H2O2的浓度为0.06mol/L,此时HCHO的转化率为90%.(忽略H2O2的分解)
(6)催化条件下,H2O2可将X(分子式为C6H6O,含苯环)转化为Y(分子式为C6H6O2),Y中苯环上的氢原子被氯原子取代后只有一种一氯代物,X转化为Y的化学方程式是:
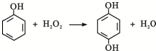 .
.
分析 (1)根据结构式的定义来解答,一对共用电子对用一个短线来表示;
(2)双氧水有强氧化性;
(3)根据化合价升高总数和降低总数相等;
(4)氧气、水得电子生成HO2-;
(5)根据反应方程式和反应的H2O2确定消耗的HCHO,然后确定转化率;
(6)Y中苯环上的氢原子被氯原子取代后只有一种一氯代物,说明苯环上只有一种氢原子;
解答 解:(1)一对共用电子对用一个短线来表示,所以结构式为:H-O-O-H,故答案为:H-O-O-H;
(2)双氧水有强氧化性,能杀菌消毒,故答案为:B;
(3)根据化合价升高总数和降低总数相等可知离子方程式:2ClO3-+2H++H2O2=O2↑+2ClO2+2H2O,故答案为:2;2;1;1;2;2;
(4)氧气、水在正极得电子生成HO2-,电极反应式是O2+H2O+2e-=HO2-+OH-,故答案为:a;O2+H2O+2e-=HO2-+OH-;
(5)反应的H2O2的浓度为0.15mol/L-0.06mol/L=0.09mol/L,根据HCHO+2H2O2=CO2+2H2O可知,反应的甲醛为0.045mol/L,HCHO的转化率为$\frac{0.045mol/L}{0.05mol/L}$=90%,故答案为:90%;
(6)Y中苯环上的氢原子被氯原子取代后只有一种一氯代物,说明苯环上只有一种氢原子,化学方程式是: ,故答案为:
,故答案为: .
.
点评 本题考查有机物的结构与性质、化学方程式的计算等,把握氧化还原反应的配平方法为解答的关键,题目难度不大.

练习册系列答案
相关题目
7.已知下表均为烷烃分子的化学式,且它们的一元取代物只有一种,问第五项烷烃化学式为( )
| 1 | 2 | 3 | 4 | 5 | 6 | … |
| CH4 | C2H6 | C5H12 | C8H18 | … | … | … |
| A. | C26H54 | B. | C17H36 | C. | C80H162 | D. | C106H214 |
5.有机物甲、乙、丙(CH3COOC2H5)、丁 (CH3 CHO)与乙醇的转化关系如图所示.下列判断不正确的是( )


| A. | 甲是乙烯 | B. | 乙可能是葡萄糖 | ||
| C. | 丙与NaOH溶液反应不能生成乙醇 | D. | 丁十H2→乙醇的反应属于加成反应 |
12.下列反应的离子方程式中,不正确的是( )
| A. | Na2SiO3溶液中滴加适量稀HCl制硅酸胶体:SiO32-+2H+═H2SiO3(胶体) | |
| B. | 用稀HNO3清洗试管壁上的银镜:3Ag+4H++NO3-═3Ag++NO↑+2H2O | |
| C. | (NH4)2SO4溶液与过量Ba(OH)2溶液混合:NH4++SO42-+Ba2++OH-═BaSO4↓+NH3•H2O | |
| D. | SO2通入氯水中:Cl2+SO2+2H2O═SO42-+2Cl-+4H+ |
2.在一定条件下,可逆反应2A(气)+B(气)?nC(固)+D(气)达平衡.若维持温度不变,增大压强,测得混合气体的平均相对分子质量不发生改变,则下列说法正确的是( )
| A. | 其他条件不变,增大压强,平衡不发生移动 | |
| B. | 其他条件不变,增大压强,混合气体的总质量不变 | |
| C. | 该反应式中n值一定为2 | |
| D. | 原混合气体中A与B的物质的量之比为2:1,且2M(A)+M(B)=3M(D)(其中M表示物质的摩尔质量) |
6.尿素是蛋白质代谢的产物,也是重要的化学肥料.工业合成尿素反应如下:
2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)
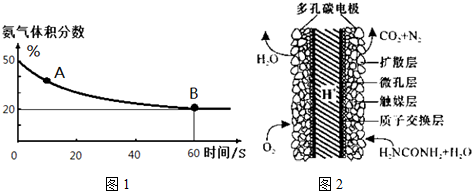
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图1所示.A点的正反应速率v正(CO2)>B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);
氨气的平衡转化率为75%.
(2)氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)═NH2COONH4(s)
将实验测得的不同温度下的平衡数据列于下表:
①关于上述反应的焓变、熵变说法正确的是A.
A.△H<0,△S<0B.△H>0,△S<0 C.△H>0,△S>0D.△H<0,△S>0
②关于上述反应的平衡状态下列说法正确的是C
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
③氨基甲酸铵极易水解成碳酸铵,酸性条件水解更彻底.将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素.
此时溶液中c(NH4+)=0.1mol/L;
NH4+水解平衡常数值为4×10-9.
(3)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电.尿素燃料电池结构如图2所示,写出该电池的负极反应式:CO(NH2)2+H2O-6e-=CO2+N2+6H+.
2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)

(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图1所示.A点的正反应速率v正(CO2)>B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);
氨气的平衡转化率为75%.
(2)氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)═NH2COONH4(s)
将实验测得的不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.△H<0,△S<0B.△H>0,△S<0 C.△H>0,△S>0D.△H<0,△S>0
②关于上述反应的平衡状态下列说法正确的是C
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
③氨基甲酸铵极易水解成碳酸铵,酸性条件水解更彻底.将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素.
此时溶液中c(NH4+)=0.1mol/L;
NH4+水解平衡常数值为4×10-9.
(3)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电.尿素燃料电池结构如图2所示,写出该电池的负极反应式:CO(NH2)2+H2O-6e-=CO2+N2+6H+.
 我国黄铁矿(主要成分:FeS2、SiO2)储量丰富,目前主要利用黄铁矿资源生产硫酸等无机化工产品.
我国黄铁矿(主要成分:FeS2、SiO2)储量丰富,目前主要利用黄铁矿资源生产硫酸等无机化工产品. ①烧渣用稀硫酸浸取时有单质硫生成,生成单质硫的一步化学反应方程式为H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4;
①烧渣用稀硫酸浸取时有单质硫生成,生成单质硫的一步化学反应方程式为H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4;