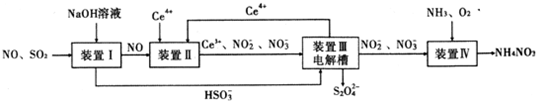
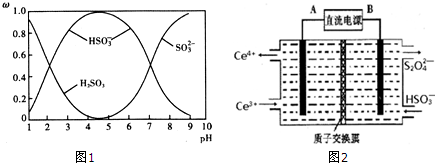
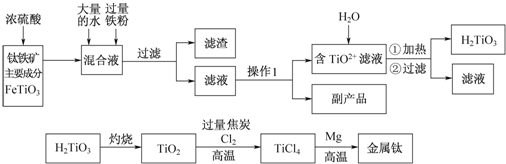
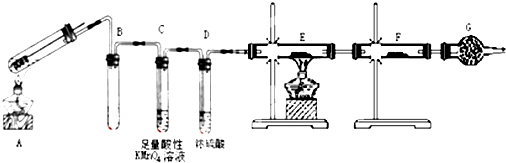
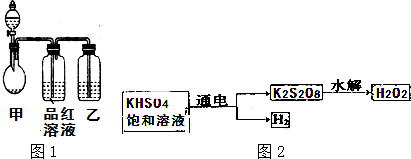
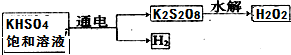
15.NA表示阿伏伽德罗常数,下列说法中正确的是( )
| A. | 常温常压下,质量为32gO2含有的原子数为2NA | |
| B. | 2L0.1mol/LNaCl溶液中含有NaCl分子数为0.2NA | |
| C. | 78gNa2O2与足量CO2完全反应吗,转移的电子数为2NA | |
| D. | 在25℃,101Pa条件下,11.2L氯气所含的原子数为NA |
14.在限定条件下,对个有机物的同分异构体数目(不考虑立体异构)判断正确的是( )
| A | B | C | D | |
| 分子式 | C4H8 | C4H8Cl2 | C4H10O | C5H10O2 |
| 限定条件 | 能发生加成反应 | 只有一个甲基 | 能与钠反应 | 只有一种官能团 |
| 数目 | 3 | 5 | 3 | 2 |
| A. | A | B. | B | C. | C | D. | D |
10.一氧化碳是一种用途十分广泛的化工基础原料.
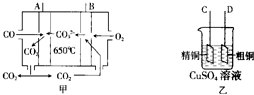
(1)在高温下一氧化碳可将二氧化硫还原为单质硫.
乙知:C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol
CO2(g)+C(s)=2CO(g)△H2=172.5kJ/mol
S(s)+O2(g)=SO2(g)△H3=-296.0kJ/mol
则CO还原SO2生成CO2(g)和S(s)的热化学方程为2CO(g)+SO2(g)=S(s)+2CO2(g);△H3=-270 kJ•mol-1.
(2)工业上一般采用CO与H2在一定条件下反应合成甲醇,反应为:CO(g)+2H2(g)?CH3OH(g).在不同温度下的化学平衡常数(K)如表:
①某温度下,将2molCO(g)和6molH2(g)充入2L的密闭容器中,充分反应后,达到平衡时c(CO)=0.5mol/L,则CO(g)的转化率为50%,此时的温度为300°C.
②在恒容条件下,要提高CO(g)的转化率,呵以采取的措施有DE(填字母序号).
A.升高温度 B.加入催化剂 C.增加CO(g)的浓度D.充入H2(g)加压 E.分离出甲醇 F.充入稀有气体加压
③实际生产过程中,合成气要进行循环,其目的是提高原料利用率.
(3)如图图甲是一碳酸盐燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质;图乙是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验.
请问答下列问题:
①A极的电极反应式为CO-2e-+CO32-=2CO2.
②进行粗铜精炼实验时,B极应该与D极(填“C”或“D”)相连.
③当消耗2.24L(标准状况下)CO时,粗铜电极理论上减少铜的质量小于(填“大于”“等于”或“小于”)6.4克.

(1)在高温下一氧化碳可将二氧化硫还原为单质硫.
乙知:C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol
CO2(g)+C(s)=2CO(g)△H2=172.5kJ/mol
S(s)+O2(g)=SO2(g)△H3=-296.0kJ/mol
则CO还原SO2生成CO2(g)和S(s)的热化学方程为2CO(g)+SO2(g)=S(s)+2CO2(g);△H3=-270 kJ•mol-1.
(2)工业上一般采用CO与H2在一定条件下反应合成甲醇,反应为:CO(g)+2H2(g)?CH3OH(g).在不同温度下的化学平衡常数(K)如表:
| 温度 | 250 | 300 | 350 |
| K | 2.041 | 0.250 | 0.012 |
②在恒容条件下,要提高CO(g)的转化率,呵以采取的措施有DE(填字母序号).
A.升高温度 B.加入催化剂 C.增加CO(g)的浓度D.充入H2(g)加压 E.分离出甲醇 F.充入稀有气体加压
③实际生产过程中,合成气要进行循环,其目的是提高原料利用率.
(3)如图图甲是一碳酸盐燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质;图乙是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验.
请问答下列问题:
①A极的电极反应式为CO-2e-+CO32-=2CO2.
②进行粗铜精炼实验时,B极应该与D极(填“C”或“D”)相连.
③当消耗2.24L(标准状况下)CO时,粗铜电极理论上减少铜的质量小于(填“大于”“等于”或“小于”)6.4克.
9.以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3•6H2O)的工艺流程如图:
回答下列问题:
(1)煅烧时粉碎硫铁矿的目的是增大反应物的接触面积,提高原料的利用率.该反应的化学方程式4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,该反应中被氧化的元素是S和Fe.
(2)酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率、抑制Fe3+水解;
(3)操作a为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,获得FeCl3•6H2O;
(4)焙烧产生的二氧化硫可以用来生产硫酸,其中利用催化氧化反应将SO2转化为SO3是一个关键步骤.压强及温度对SO2转化率的影响如下表:
根据表中的数据判断该反应的正向属于放热(填“放热“或”吸热“)反应,理由是压强一定时,温度升高,SO2转化率下降,说明升温平衡逆向移动,则正向放热.
(5)计算每生产1万吨98%硫酸所需要含80%FeS2的硫铁矿为7894.7吨(假设反应过程中硫的损失率为5%,结果保留一位小数).
0 167208 167216 167222 167226 167232 167234 167238 167244 167246 167252 167258 167262 167264 167268 167274 167276 167282 167286 167288 167292 167294 167298 167300 167302 167303 167304 167306 167307 167308 167310 167312 167316 167318 167322 167324 167328 167334 167336 167342 167346 167348 167352 167358 167364 167366 167372 167376 167378 167384 167388 167394 167402 203614

回答下列问题:
(1)煅烧时粉碎硫铁矿的目的是增大反应物的接触面积,提高原料的利用率.该反应的化学方程式4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,该反应中被氧化的元素是S和Fe.
(2)酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率、抑制Fe3+水解;
(3)操作a为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,获得FeCl3•6H2O;
(4)焙烧产生的二氧化硫可以用来生产硫酸,其中利用催化氧化反应将SO2转化为SO3是一个关键步骤.压强及温度对SO2转化率的影响如下表:
| 0.1 | 0.5 | 1 | 10 | |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
(5)计算每生产1万吨98%硫酸所需要含80%FeS2的硫铁矿为7894.7吨(假设反应过程中硫的损失率为5%,结果保留一位小数).