13.下列结论中你认为肯定正确的是( )
①微粒半径:S2->Cl->Na+>Al3+ ②氢化物的稳定性:HF>HCl>H2S>H2Se
③氧化性:Cl2>S>Se>Te ④酸性:H2SO4>HClO4>H2SeO4
⑤得电子能力:F>Cl>Br>I ⑥还原性:F->Cl->Br-.
①微粒半径:S2->Cl->Na+>Al3+ ②氢化物的稳定性:HF>HCl>H2S>H2Se
③氧化性:Cl2>S>Se>Te ④酸性:H2SO4>HClO4>H2SeO4
⑤得电子能力:F>Cl>Br>I ⑥还原性:F->Cl->Br-.
| A. | 只有① | B. | ①②④⑥ | C. | ①②③⑤ | D. | 只有⑤ |
12.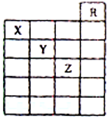 如图是元素周期表前六周期的一部分,关于元素X、Y、Z的叙述正确的是( )
如图是元素周期表前六周期的一部分,关于元素X、Y、Z的叙述正确的是( )
①X的气态氢化物与Y最高价氧化物对应的水化物能发生反应生成盐
②X、Y的气态氢化物的水溶液的酸性X<Y
③Z的单质常温下的是液体,可与铁粉反应
④Z的原子序数比Y大19
⑤Z所在的周期中含有32种元素.
 如图是元素周期表前六周期的一部分,关于元素X、Y、Z的叙述正确的是( )
如图是元素周期表前六周期的一部分,关于元素X、Y、Z的叙述正确的是( )①X的气态氢化物与Y最高价氧化物对应的水化物能发生反应生成盐
②X、Y的气态氢化物的水溶液的酸性X<Y
③Z的单质常温下的是液体,可与铁粉反应
④Z的原子序数比Y大19
⑤Z所在的周期中含有32种元素.
| A. | 只有①③ | B. | 只有①④ | C. | 只有①②③④ | D. | 全部都是 |
11.下列说法正确的是( )
| A. | 含有金属元素的化合物一定是离子化合物 | |
| B. | 含有共价键的化合物就是共价化合物 | |
| C. | 含有离子键的化合物就是离子化合物 | |
| D. | 多种非金属元素之间形成的共价键一定是极性键 |
7.甲烷在高温下可分解生成C2H2和H2.一定量的甲烷部分分解成C2H2和H2后,仍有CH4剩余,所得混合物的平均式量为12.8,则甲烷的分解率为( )
| A. | 10% | B. | 25% | C. | 50% | D. | 75% |
6.1,2,3-三苯基环丙烷的三个苯基可以分布在环丙烷环平面的上下,因此有如下两个异构体: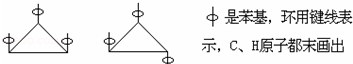
据此,可判断1,2,3,4,5-五氯环戊烷(假定五个碳原子也处于同一平面上)的异构体数目是( )

据此,可判断1,2,3,4,5-五氯环戊烷(假定五个碳原子也处于同一平面上)的异构体数目是( )
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
5.下表为元素周期表的一部分,参照元素①~⑨在表中的位置,按要求回答下列问题:
(1)在标号元素中,最活泼的金属元素名称是钠最活泼的非金属元素名称是氟.
⑨元素的原子结构简示意图 .
.
(2)用电子式表示 ①与②形成共价化合物的形成过程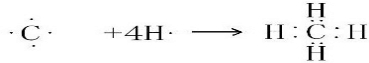 .
.
(3)⑤、⑥、⑦三种元素的原子半径由大到小的顺序是⑤>⑥>⑦(序号表示).
(4)①~⑨元素所形成的气态氢化物中,最稳定的是HF(化学式表示)
⑦、⑧、⑨三种元素的气态氢化物的稳定由强到弱的顺序HCl>PH3>SiH4(化学式表示).
(5)写出元素⑨的单质与溴化钠反应的离子方程式:2Br-+Cl2=2Cl-+Br2.
0 167200 167208 167214 167218 167224 167226 167230 167236 167238 167244 167250 167254 167256 167260 167266 167268 167274 167278 167280 167284 167286 167290 167292 167294 167295 167296 167298 167299 167300 167302 167304 167308 167310 167314 167316 167320 167326 167328 167334 167338 167340 167344 167350 167356 167358 167364 167368 167370 167376 167380 167386 167394 203614
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | |||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
⑨元素的原子结构简示意图
 .
.(2)用电子式表示 ①与②形成共价化合物的形成过程
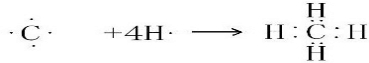 .
.(3)⑤、⑥、⑦三种元素的原子半径由大到小的顺序是⑤>⑥>⑦(序号表示).
(4)①~⑨元素所形成的气态氢化物中,最稳定的是HF(化学式表示)
⑦、⑧、⑨三种元素的气态氢化物的稳定由强到弱的顺序HCl>PH3>SiH4(化学式表示).
(5)写出元素⑨的单质与溴化钠反应的离子方程式:2Br-+Cl2=2Cl-+Br2.

 .
. (写出结构简式).
(写出结构简式).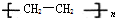 (塑料)、
(塑料)、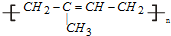 (橡胶).
(橡胶).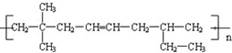 的单体为CH2=C(CH3)2、CH2=CH-CH=CH2、CH2=CHCH2CH3.
的单体为CH2=C(CH3)2、CH2=CH-CH=CH2、CH2=CHCH2CH3. .
.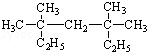 系统命名为3,3,5,5-四甲基庚烷
系统命名为3,3,5,5-四甲基庚烷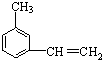
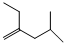 .
.