题目内容
7.甲烷在高温下可分解生成C2H2和H2.一定量的甲烷部分分解成C2H2和H2后,仍有CH4剩余,所得混合物的平均式量为12.8,则甲烷的分解率为( )| A. | 10% | B. | 25% | C. | 50% | D. | 75% |
分析 令甲烷的物质的量为1mol,设分解的甲烷为xmol,根据方程式计算反应后混合气体的总的物质的量,根据质量守恒可知,反应后混合气体的质量等于起始甲烷的质量,根据m=nM计算出甲烷分解的物质的量,再求出分解率.
解答 解:令甲烷的物质的量为1mol,设分解的甲烷为xmol,则:
2CH4→C2H2+3H2 气体物质的量增大
2 2
xmol xmol
故反应后气体的总的物质的量为1mol+xmol,
故反应后混合气体的平均摩尔质量=$\frac{1mol×16g/mol}{(1+x)mol}$=12.8g/mol,
则x=0.25
则甲烷的分解率为$\frac{0.25mol}{1mol}$×100%=25%,
故选B.
点评 本题考查混合物的有关计算,难度不大,根据方程式计算反应后混合气体的总的物质的量是关键,注意把握公式的应用.

练习册系列答案
相关题目
18.下表对某些反应方程式的评价合理的是( )
| 编号 | 离子方程式或电极反应式 | 评价 | |
| A | 次氯酸钙溶液中通入足量SO2 | Ca2++C1O-+SO2+H2O=CaSO4+ C1-+2H+ | 正确 |
| B | 硫酸铁溶液与氢氧化钡溶液混合 | Fe3++SO42-+Ba2++3OH-= Fe(OH)3↓+BaSO4↓ | 正确 |
| C | 醋酸铵溶于水 | CH3COO-+NH4+?CH3COOH+NH3•H2O | 错误,阴离子水解相互促进,应该用“=”号 |
| D | 用惰性电极电解氯化铜和氯化钠的混合溶液一段时间 | 阴极:2Cu2++4e-=2Cu 阳极:4OH--4e-=2H2O+O2↑ | 错误,该阴阳两极反应不可能同时发生 |
| A. | A | B. | B | C. | C | D. | D |
15.用如图装置进行实验,将液体A逐渐加入到固体B中,下列叙述正确的是( )
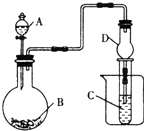

| A. | 若A为浓盐酸,B为KMnO4(KMnO4在常温下能与浓盐酸反应),C中盛品红溶液,则C中溶液褪色 | |
| B. | 若A为硫酸,B为大理石,C中盛澄清石灰水,则C中溶液先出现浑浊后变澄清 | |
| C. | 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀溶解 | |
| D. | 上述实验中仪器D可以用长玻璃导管代替 |
2.下列化学用语正确的是( )
| A. | 8个质子10个中子的核素符号:10Ar | B. | H2O的电子式: | ||
| C. | 四氯化碳的电子式: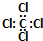 | D. | S2-离子的结构示意图: |
12.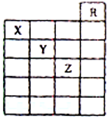 如图是元素周期表前六周期的一部分,关于元素X、Y、Z的叙述正确的是( )
如图是元素周期表前六周期的一部分,关于元素X、Y、Z的叙述正确的是( )
①X的气态氢化物与Y最高价氧化物对应的水化物能发生反应生成盐
②X、Y的气态氢化物的水溶液的酸性X<Y
③Z的单质常温下的是液体,可与铁粉反应
④Z的原子序数比Y大19
⑤Z所在的周期中含有32种元素.
 如图是元素周期表前六周期的一部分,关于元素X、Y、Z的叙述正确的是( )
如图是元素周期表前六周期的一部分,关于元素X、Y、Z的叙述正确的是( )①X的气态氢化物与Y最高价氧化物对应的水化物能发生反应生成盐
②X、Y的气态氢化物的水溶液的酸性X<Y
③Z的单质常温下的是液体,可与铁粉反应
④Z的原子序数比Y大19
⑤Z所在的周期中含有32种元素.
| A. | 只有①③ | B. | 只有①④ | C. | 只有①②③④ | D. | 全部都是 |
19.我们在昏暗的光线下看见物体,离不开视网膜中一种叫“视黄醛”(见甲)的有机物,而与视黄醛相似结构的维生素A(见乙)常作为保健药物,则下列有关叙述正确的是( )

| A. | 视黄醛的分子式为C24H20O | |
| B. | 维生素A分子结构中含有苯环、碳碳双键和羟基 | |
| C. | 维生素A是视黄醛的氧化产物 | |
| D. | 1mol视黄醛在一定条件下最多能与8molH2发生反应 |
16.下列各组物质中,硫元素的化合价均为+4的是( )
| A. | Na2SO3 | B. | H2S2O7 | C. | Na2SO4 | D. | Na2S2O3 |
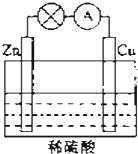 电能是现代社会应用最广泛的能源之一.如图所示的原电池装置中,其负极是Zn,正极上能够观察到的现象是铜片表面产生无色气泡,正极的电极反应式是2H++2e-=H2↑.原电池工作一段时间后,若消耗锌6.5g,则放出气体0.2g.
电能是现代社会应用最广泛的能源之一.如图所示的原电池装置中,其负极是Zn,正极上能够观察到的现象是铜片表面产生无色气泡,正极的电极反应式是2H++2e-=H2↑.原电池工作一段时间后,若消耗锌6.5g,则放出气体0.2g.