题目内容
14.(1)H、D、T三种原子,它们之间的关系是同位素,在标准状况下,它们的单质的密度之比是1:2:3,在标准状况下,1L各种单质中它们的电子数之比是1:1:1.(2)某非金属X的最高正价为+m,它的最高价氧化物的水化物中有b个氧原子和一个X原子,该酸的化学式为H2b-mXOb.
(3)含有6.02×1023个中子的Li的质量是 g;4g D2和20g18O2的单质化合时最多可以生成22gD218O.
分析 (1)H、D、T三种原子均为氢元素的原子;根据公式ρ=进行判断;先分析每个分子中的电子数,再判断相同体积的三种物质中含有的电子数;
(2)非金属X的最高正价为+m,最高价氧化物对应的水化物中有b个氧原子,利用正负化合价的代数和为0来分析;
(3)根据n=计算中子物质的量,Li+的中子数为7-3=4,进而计算Li+的物质的量,再根据m=nM计算;进行过量计算,根据不足量的物质计算生成D2O的质量.
解答 解:(1)H、D、T三种原子质子数相同,中子数不同,互称同位素;
密度公式为:ρ==,相同条件下,Vm相同,所以其密度之比等于其摩尔质量之比,为1:2:3;
每个H2、D2、T2分子中含有的电子数都是2,相同条件下,体积相同的三种单质中含有的电子数相等,所以比为1:1:1,
故答案为:同位素;1:2:3; 1:1:1;
(2)非金属X的最高正价为+m,最高价氧化物对应的水化物中有b个氧原子,由正负化合价的代数和为0,则设H原子个数为x,所以x+(+m)+(-2)×b=0,解得x=2b-m,所以酸的化学式为H2b-mXOb,故答案为:H2b-mXOb;
(3)6.02×1023个中子物质的量==1mol,Li+的中子数为7-3=4,故Li+的物质的量为=0.25mol,Li+的质量=0.25mol×7g/mol=g;
2D2+18O2 =2 D218O
8 36 44
4g 18g 22g
故氢气不足,根据氢气计算生成D2O的质量=4g×=22g,
故答案为:;22.
点评 本题考查过量计算、物质的量的有关计算等,明确元素的位置与化合价、原子序数的关系等来确定物质的化学式即可解答,注意化合物中正负化合价的代数和为0,题目难度较大.

练习册系列答案
相关题目
5.任何科学真理的发现,都不是一帆风顺的,门捷列夫的元素周期表奠定了现代化学和物理学的理论基础.下列关于元素周期表的说法中,不正确的是( )
| A. | 周期表中的副族、Ⅷ族都是金属元素 | |
| B. | 周期表中的ⅡA族都是金属元素 | |
| C. | 周期表中的非金属元素都位于短周期 | |
| D. | 周期表中的0族元素都是非金属元素 |
2.下列化学用语正确的是( )
| A. | 8个质子10个中子的核素符号:10Ar | B. | H2O的电子式: | ||
| C. | 四氯化碳的电子式: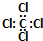 | D. | S2-离子的结构示意图: |
19.我们在昏暗的光线下看见物体,离不开视网膜中一种叫“视黄醛”(见甲)的有机物,而与视黄醛相似结构的维生素A(见乙)常作为保健药物,则下列有关叙述正确的是( )

| A. | 视黄醛的分子式为C24H20O | |
| B. | 维生素A分子结构中含有苯环、碳碳双键和羟基 | |
| C. | 维生素A是视黄醛的氧化产物 | |
| D. | 1mol视黄醛在一定条件下最多能与8molH2发生反应 |
3.在水溶液中能够大量共存的是( )
| A. | Na+、C1-、NO3-、Ba2+ | B. | Ag+、C1-、NO3-、Ca2+ | ||
| C. | NH4+、OH-、SO42-、Cu2+ | D. | Na+、Fe2+、OH-、H+ |

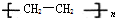 (塑料)、
(塑料)、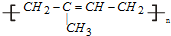 (橡胶).
(橡胶).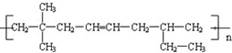 的单体为CH2=C(CH3)2、CH2=CH-CH=CH2、CH2=CHCH2CH3.
的单体为CH2=C(CH3)2、CH2=CH-CH=CH2、CH2=CHCH2CH3. .
. 、
、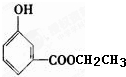 、
、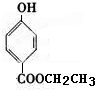 .
. 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ/mol、-283.0kJ/mol和-726.5kJ/mol.请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ/mol、-283.0kJ/mol和-726.5kJ/mol.请回答下列问题: