题目内容
13.下列结论中你认为肯定正确的是( )①微粒半径:S2->Cl->Na+>Al3+ ②氢化物的稳定性:HF>HCl>H2S>H2Se
③氧化性:Cl2>S>Se>Te ④酸性:H2SO4>HClO4>H2SeO4
⑤得电子能力:F>Cl>Br>I ⑥还原性:F->Cl->Br-.
| A. | 只有① | B. | ①②④⑥ | C. | ①②③⑤ | D. | 只有⑤ |
分析 ①是微粒半径大小比较,电子层不同的,电子层越多半径越大;电子层相同的,质子数越多半径越小,据此判断.
②③④⑤比较的是元素非金属性强弱,元素的非金属性越强,气态氢化物的稳定性越强,单质的氧化性越强,最高价氧化物对应水化物的酸性越强,原子得电子能力越强,离子的还原性越弱,据此解答.
解答 解:①S2-、Cl-三个电子层,Na+、Al3+ 有两个电子层,所以前两种微粒半径大于后两种,然后再根据“径小序大”的原则判断微粒半径:S2->Cl->Na+>Al3+,故①正确;
②非金属性由强到弱顺序:F>Cl>S>Se,所以气态氢化物稳定性顺序:HF>HCl>H2S>H2Se,故②正确;
③非金属性由强到弱顺序:Cl>S>Se>Te,所以单质的氧化性顺序:Cl2>S>Se>Te,故③正确;
④非金属性由强到弱顺序:Cl>S>Se,所以最高价氧化物对应水化物酸性顺序:H4ClO4>H2SO4>H2SeO4,故④错误;
⑤非金属性由强到弱顺序:F>Cl>Br>I,所以原子得电子能力强弱顺序::F>Cl>Br>I,故⑤正确;
⑥非金属性越强,阴离子的还原性越弱,非金属性:F>Cl>Br,则还原性:F-<Cl-<Br-.故⑥错误.
故选C.
点评 本题考查了微粒半径大小的比较,元素非金属性强弱判断依据,题目难度不大,解题时关键是根据元素周期表和周期律判断出元素非金属性强弱.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
3.下列结论错误的是( )
①微粒半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO4
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K
⑧沸点:H2Se>H2S>H2O.
①微粒半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO4
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K
⑧沸点:H2Se>H2S>H2O.
| A. | ①⑤ | B. | ①③⑤⑧ | C. | ②④⑥⑦ | D. | ②④⑥ |
4.如图是氩元素在元素周期表中的具体信息.其中39.95是( )


| A. | 氩的原子序数 | B. | 氩原子的质量数 | ||
| C. | 氩元素的相对原子质量 | D. | 氩原子的相对原子质量 |
1.元素周期表中某区域的一些元素多用于制造半导体材料,它们是( )
| A. | 左、下方区域的金属元素 | |
| B. | 右、上方区域的非金属元素 | |
| C. | 金属元素与非金属元素分界线附近的元素 | |
| D. | 过渡元素中 |
18.某有机物A是农药生产中的一种中间体,其结构简式如图.则下列叙述正确的是( )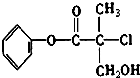

| A. | 有机物A分子式为C10H12O3Cl | |
| B. | 有机物A可以和Br2的CCl4溶液发生加成反应 | |
| C. | 有机物A和浓硫酸混合加热,可以发生消去反应 | |
| D. | 1molA和足量的NaOH溶液反应,最多可以消耗3mol NaOH |
2.不属于乙酸化学性质的是( )
| A. | 可与金属钠反应 | B. | 能与碱发生中和反应 | ||
| C. | 可被氧化成乙醛 | D. | 可与乙醇发生酯化反应 |
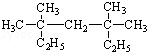 系统命名为3,3,5,5-四甲基庚烷
系统命名为3,3,5,5-四甲基庚烷
 .
.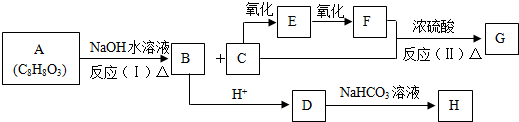
 ;B:
;B: ;E:HCHO G:HCOOCH3
;E:HCHO G:HCOOCH3 .
.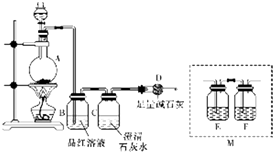 为探究某铁碳合金与浓硫酸在加热条件下反应的部分产物并测定铁碳合金中铁元素的质量分数,某化学活动小组设计了如图所示的实验装置,并完成以下实验探究.往圆底烧瓶中加入mg铁碳合金,并滴入过量浓硫酸,点燃酒精灯.
为探究某铁碳合金与浓硫酸在加热条件下反应的部分产物并测定铁碳合金中铁元素的质量分数,某化学活动小组设计了如图所示的实验装置,并完成以下实验探究.往圆底烧瓶中加入mg铁碳合金,并滴入过量浓硫酸,点燃酒精灯.