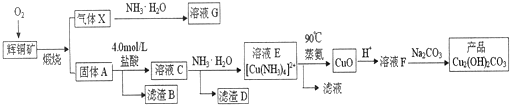
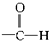4.将三种黑色粉末组成的混和物加入到100mL 14mol/L某热浓酸中,充分反应后得到蓝绿色溶液和两种气体;将从蓝绿色溶液中分离得到的盐与0.15mol还原铁粉恰好反应完全,可得浅绿色溶液和6.4g红色沉淀;将上述生成的两种气体通入足量饱和NaHCO3溶液中,仍然收集到两种气体,据此推断黑色粉末可能为( )
| A. | 物质的量 FeS:CuO:Fe=1:1:1 | |
| B. | 物质的量 C:CuO:Fe=3:2:2 | |
| C. | 质量 MnO2:CuO:C=5.5:8:1.2 | |
| D. | 质量 Fe:C:CuO=7:5:3 |
3.黑色金属材料是工业上对铁、铬和锰的统称,这三种金属都是冶炼钢铁的主要原料,回答下列问题.
(1)基态铬原子有6个未成对电子;一价锰离子的核外电子排布式为1s22s22p63s23p63d54s1;晶体盐是一种配合物,化学式为Kx[Fe(CN)]Y•3H2O,该配合物中配体的化学式为CN-,与该配体互为等电子的分子有N2(举一例).
(2)酸性KMnO4能将甲苯氧化为苯甲酸,甲苯中碳原子的杂化轨道类型为sp3;甲酸苯酚酯是苯甲酸的同分异构体,但沸点比苯甲酸低得多,其原因是苯甲酸分子间存在氢键,熔点、沸点增大;
高锰酸的结构式为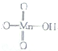 它属于强(填“强”或“弱”)酸.
它属于强(填“强”或“弱”)酸.
(3)Fe3+是H2O分解的催化剂,已知下列键能数据;
①1molH2O中含α键的数目为2mol.
②2H2O2(l)=2H2O(l)+O2(g),该分解反应为放(填“放”或“吸”)热反应.
(4)每个金属铬晶胞中有2个Cr原子,则晶胞中Cr原子的配位数为8;其晶胞边长为αcm,则铬单质约密度为$\frac{104}{{a}^{3}N{\;}_{A}}$g•cm-3(不必计算出结果).
(1)基态铬原子有6个未成对电子;一价锰离子的核外电子排布式为1s22s22p63s23p63d54s1;晶体盐是一种配合物,化学式为Kx[Fe(CN)]Y•3H2O,该配合物中配体的化学式为CN-,与该配体互为等电子的分子有N2(举一例).
(2)酸性KMnO4能将甲苯氧化为苯甲酸,甲苯中碳原子的杂化轨道类型为sp3;甲酸苯酚酯是苯甲酸的同分异构体,但沸点比苯甲酸低得多,其原因是苯甲酸分子间存在氢键,熔点、沸点增大;
高锰酸的结构式为
 它属于强(填“强”或“弱”)酸.
它属于强(填“强”或“弱”)酸.(3)Fe3+是H2O分解的催化剂,已知下列键能数据;
| 化学键 | H-O | O-O | O-O |
| 键能/(J.mol-1) | 163 | 142 | 438 |
②2H2O2(l)=2H2O(l)+O2(g),该分解反应为放(填“放”或“吸”)热反应.
(4)每个金属铬晶胞中有2个Cr原子,则晶胞中Cr原子的配位数为8;其晶胞边长为αcm,则铬单质约密度为$\frac{104}{{a}^{3}N{\;}_{A}}$g•cm-3(不必计算出结果).
17.填写下表:
0 167183 167191 167197 167201 167207 167209 167213 167219 167221 167227 167233 167237 167239 167243 167249 167251 167257 167261 167263 167267 167269 167273 167275 167277 167278 167279 167281 167282 167283 167285 167287 167291 167293 167297 167299 167303 167309 167311 167317 167321 167323 167327 167333 167339 167341 167347 167351 167353 167359 167363 167369 167377 203614
| 类 别 | 典型代表物名称 | 官能团名称 | 结构简式 |
| 醇 | 乙醇 | 羟基 | CH3CH2OH |
| 酚 | 苯酚 | 羟基 |  |
| 醛 | 乙醛 | 醛基 | CH3CHO |
| 羧酸 | 乙酸 | 羧基 | CH3COOH |
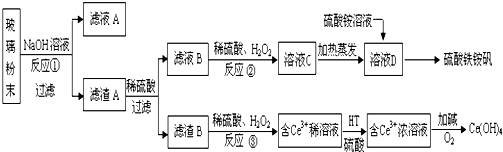
 $\stackrel{AlCl_{3}}{→}$
$\stackrel{AlCl_{3}}{→}$ +HCl,下列是由苯制取有机物“茚”的反应过程:
+HCl,下列是由苯制取有机物“茚”的反应过程: $\stackrel{SOCl_{2}}{→}$
$\stackrel{SOCl_{2}}{→}$ $→_{②}^{博.克反应}$X$→_{③}^{H_{2}/催化剂}$
$→_{②}^{博.克反应}$X$→_{③}^{H_{2}/催化剂}$ $→_{④}^{浓H_{2}SO_{4}/△}$茚
$→_{④}^{浓H_{2}SO_{4}/△}$茚 、茚
、茚 ;
; 互为同分异构体,有一苯环且苯环上有互为对位的2个取代基,并能与NaOH反应的有机物的结构简式(写出三种)
互为同分异构体,有一苯环且苯环上有互为对位的2个取代基,并能与NaOH反应的有机物的结构简式(写出三种) .
. 有下列性质AD
有下列性质AD 的合成路线流程图(其他无机试剂任选).
的合成路线流程图(其他无机试剂任选).
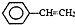 ),聚苯乙烯的化学式为
),聚苯乙烯的化学式为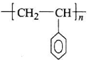
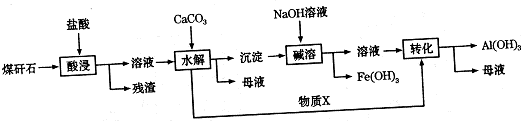
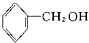 酚类-OH②
酚类-OH②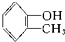 醇类-OH③
醇类-OH③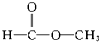 酯类
酯类
 醚类
醚类