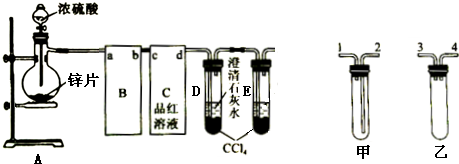
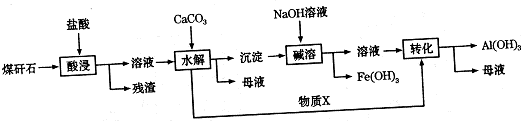
题目内容
3.黑色金属材料是工业上对铁、铬和锰的统称,这三种金属都是冶炼钢铁的主要原料,回答下列问题.(1)基态铬原子有6个未成对电子;一价锰离子的核外电子排布式为1s22s22p63s23p63d54s1;晶体盐是一种配合物,化学式为Kx[Fe(CN)]Y•3H2O,该配合物中配体的化学式为CN-,与该配体互为等电子的分子有N2(举一例).
(2)酸性KMnO4能将甲苯氧化为苯甲酸,甲苯中碳原子的杂化轨道类型为sp3;甲酸苯酚酯是苯甲酸的同分异构体,但沸点比苯甲酸低得多,其原因是苯甲酸分子间存在氢键,熔点、沸点增大;
高锰酸的结构式为
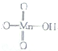 它属于强(填“强”或“弱”)酸.
它属于强(填“强”或“弱”)酸.(3)Fe3+是H2O分解的催化剂,已知下列键能数据;
| 化学键 | H-O | O-O | O-O |
| 键能/(J.mol-1) | 163 | 142 | 438 |
②2H2O2(l)=2H2O(l)+O2(g),该分解反应为放(填“放”或“吸”)热反应.
(4)每个金属铬晶胞中有2个Cr原子,则晶胞中Cr原子的配位数为8;其晶胞边长为αcm,则铬单质约密度为$\frac{104}{{a}^{3}N{\;}_{A}}$g•cm-3(不必计算出结果).
分析 (1)铬是24号元素,其原子核外有24个电子,根据排布原理写出其基态原子核外电子排布式来判断;锰离子原子序数为25号,其核外有24个电子,根据排布原理写出其基态离子核外电子排布式;根据配体提供孤电子对,中心离子提供空轨道,据此判断配体;等电子体指原子数相等价电子总数相等的微粒;
(2)由价层电子对互斥理论确定原子杂化方式;分子间存在氢键,熔点、沸点增大;含氧酸分子的结构中含非羟基(羟基为-OH)氧原子数越多,该含氧酸的酸性越强.
(3)①单键中含有1个σ键,双键中含有1个σ键、1个π键来解答;
②根据焓变=反应物的总键能-生成物的总键能计算焓变,然后判断反应的热效应;
(4)每个金属铬晶胞中有2个Cr原子,说明晶胞为体心立方堆积,中心原子最近的原子有8个,原子的配位数为8;根据ρ=$\frac{m}{V}$计算其密度.
解答 解:(1)铬是24号元素,其原子核外有24个电子,根据排布原理知其基态核外电子排布式为:1s22s22p63s23p63d54s1,未成对电子有6个;锰离子原子序数为25号,其核外有24个电子,一价锰离子的核外电子排布式为:1s22s22p63s23p63d54s1;在[Fe(CN)]YX+中CN-提供孤电子对,做配体;CN-含有2个原子,价电子总数为4+5+1=10,故其等电子体为氮气分子等;
故答案为:6;1s22s22p63s23p63d54s1;CN-;N2;
(2)甲苯中含有甲基,该分子中C原子价层电子对个数都是4,所以所有C原子采用sp3杂化;苯甲酸分子间存在氢键,熔点、沸点增大,而甲酸苯酚酯无分子间存在氢键; 中含非羟基(羟基为-OH)氧原子数已最多,该含氧酸是强酸;
中含非羟基(羟基为-OH)氧原子数已最多,该含氧酸是强酸;
故答案为:sp3杂化;苯甲酸分子间存在氢键,熔点、沸点增大;强;
(3)①H2O分子结构式为H-O-H,含有2个σ键,所以1molH2O中含α键的数目为2mol;
故答案为:2mol;
②焓变△H=反应物的总键能-生成物的总键能=(163KJ/mol×4+142KJ/mol×2)-(163KJ/mol×4+438KJ/mol)=-154KJ/mol,反应放热;
故答案为:放;
(4)每个金属铬晶胞中有2个Cr原子,说明晶胞为体心立方堆积,中心原子最近的原子有8个,原子的配位数为8;晶胞边长为αcm,晶胞体积=a3cm3,ρ=$\frac{m}{V}$=$\frac{\frac{52}{{N}_{A}}×2}{{a}^{3}}$g/cm3=$\frac{104}{{a}^{3}N{\;}_{A}}$g/cm3,
故答案为:8;$\frac{104}{{a}^{3}N{\;}_{A}}$.
点评 本题考查较综合,涉及核外电子排布、原子杂化、化学键、晶胞的计算等知识点,难度不大,难点是晶胞计算.

| A. | 反应起始时速率:X=Y | B. | 反应消耗镁的量:X<Y | ||
| C. | 产生H2量:X>Y | D. | 反应片刻后速率:X>Y |
(1)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2].已知:
①2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=-159.5kJ•mol-1
②NH2CO2NH4(s)═CO(NH2)2(s)+H2O(g)△H=+116.5kJ•mol-1
③H2O(l)═H2O(g)△H=+44.0kJ•mol-1
则反应2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)的△H=-87.0kJ•mol-1
(2)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ•mol-1.
在T1℃时,反应进行到同时间测得各物质的浓度如下;30min后,只改变某一条件,反应重新达到平衡,各物质浓度如表所.
| 时间(min) 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
②30min后,只改变某一条件,反应重新达到平衡,各物质浓度如表所示.根据上表中的数据判断改变的条件可能是bc(填字母编号).
a.加入一定量的活性炭 b.通入一定量的NO c.适当缩小容器的体积
d.加入合适的催化剂 e.升高温度
③30min后,如果将温度升高至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则 Q<0(填“>”或“<”).
| t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500s内N2O5分解速率为2.96×10-3 mol/(L•s) | |
| B. | T1温度下的平衡常数为K1=125,1000s时转化率为50% | |
| C. | 其他条件不变时,T2温度下反应到1000s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2 | |
| D. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2 |
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 10种 |
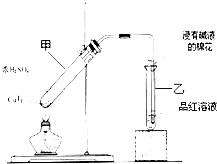 某教师在课堂上用右图所示的装置来验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质.请回答下列问题:
某教师在课堂上用右图所示的装置来验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质.请回答下列问题: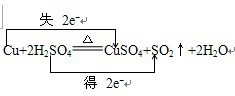 .
.