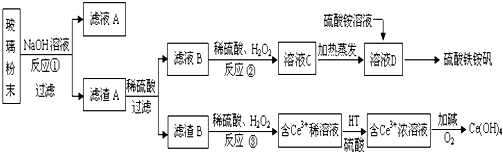
题目内容
17.填写下表:| 类 别 | 典型代表物名称 | 官能团名称 | 结构简式 |
| 醇 | 乙醇 | 羟基 | CH3CH2OH |
| 酚 | 苯酚 | 羟基 | 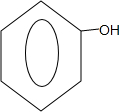 |
| 醛 | 乙醛 | 醛基 | CH3CHO |
| 羧酸 | 乙酸 | 羧基 | CH3COOH |
分析 酚的代表物为苯酚,醇、醛、酸的典型代表物为2个C的乙醇、乙醛、乙酸,官能团分别为羟基、醛基和羧基,据此分析.
解答 解:酚的代表物为苯酚,醇、醛、酸的典型代表物为2个C的乙醇、乙醛、乙酸,官能团分别为羟基、醛基和羧基,
故答案为:乙醇;羟基;CH3CH2OH;
苯酚;羟基; ;
;
乙醛;醛基;CH3CHO;
乙酸;羧基;CH3COOH.
点评 本题考查了醇、醛、酸、酚的典型代表物及其官能团,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 在酒精灯上加热铝箔 | 铝箔熔化但不滴落 | 熔点:铝>氧化铝 |
| B | 某酸雨试样中加入Ba(OH)2溶液 | 产生白色沉淀 | 酸雨试样中只含SO42- |
| C | 用玻璃棒蘸取浓硫酸点到蓝色石蕊试纸上 | 试纸变黑 | 浓硫酸具有脱水性 |
| D | 食用加碘盐加入食醋和KI溶液,再加入CCl4振荡,静置 | 下层呈紫红色 | 该食用加碘盐含有KIO3 |
| A. | A | B. | B | C. | C | D. | D |
8.下列说法中正确的是( )
| A. | 水冷却到0℃以下时变成冰,是因为水分子从液体变成了固体 | |
| B. | 所有物质在温度变化时都能表现出三态变化 | |
| C. | 不降低温度,只增大压强,也可能使物质从气态变成固态 | |
| D. | 物质能热胀冷缩是因为构成物质的微粒能够热胀冷缩 |
5.随着大气污染的日趋严重,国家拟于“十二五”期间将二氧化硫(SO2)排放减少8%,氢氧化物排放量减少10%.目前,消除大气污染有多重方法.
I.处理NO2的一种方法是利用甲烷催化还原NO2.
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ.mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H3=-867kJ.mol
则△H2=-1160kJ•mol-1
Ⅱ.化石燃料的燃烧,含硫金属矿石的冶炼和硫酸的生产过程中产生的SO2是大气中SO2的主要来源.
将煤转化为谁每期是将煤转化为结晶燃料的方法之一,反应为:C(s)+H2O(g)?CO(g)+H2(g)
一定温度下,在1.0L密闭容器中放入1molC(s)、1molH2O(g)进行反应,反应时间(t)与容器内气体总压强平(p)的数据见下表
回答下列问题:
(1)下列那些选项可以说明该可逆反应已达平衡状态AD
A.混合气体的密度不再发生改变
B.消耗1molH2O(g)的同时生成1molH2
C.△H不变
D.V正(CO)=V逆(H2)
(2)由总压强P和起始压强P0表示反应体系的总物质的量n总,n总=$\frac{P}{{P}_{0}}$mol;由表中数据计算达到平衡时,反应物H2O(g)的转化率α=79.82%(精确到小数点后第二位)
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能值得氨气,具体流程如下: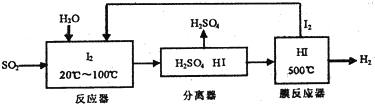
①用化学方程式表示整个过程发生的总反应SO2+2H2O=H2SO4+H2
②用化学平行移动的原理分析,在HI分解反应中使用膜反应器分离出H的目的是降低生成物的浓度,使平衡向正方向移动
Ⅲ.(1)将1.0molCH4和2.0molH2O(g)通入容积为100L的反应器,在一定条件下发生反应:
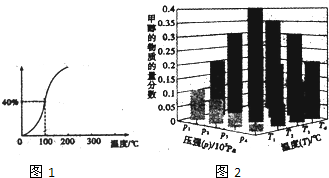
CH4(g)+H2O(g)?CO(g)+3H2(g)测得在一定的压强下CH4的平衡转换率于温度的关系如图1.100℃时该反应的平衡常数为7.2×10-5
(2)在一定温度和压强条件下发生了反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<O,反应达到平衡时,改变温度(T)和压强(P),反应混合物CH3OH“物质的量分数”变化情况如图2所示,关于温度(T)和压强(P)的关系判断准确的是CD(填序号)
A.P3>P2,T3>T2 B.P2>P4,T4>T2 C.P1>P3,T1>T3 D.P1>P4,T1>T4
I.处理NO2的一种方法是利用甲烷催化还原NO2.
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ.mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H3=-867kJ.mol
则△H2=-1160kJ•mol-1
Ⅱ.化石燃料的燃烧,含硫金属矿石的冶炼和硫酸的生产过程中产生的SO2是大气中SO2的主要来源.
将煤转化为谁每期是将煤转化为结晶燃料的方法之一,反应为:C(s)+H2O(g)?CO(g)+H2(g)
一定温度下,在1.0L密闭容器中放入1molC(s)、1molH2O(g)进行反应,反应时间(t)与容器内气体总压强平(p)的数据见下表
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.56 | 5.14 | 5.87 | 6.30 | 7.24 | 8.16 | 8.18 | 8.20 | 8.20 |
(1)下列那些选项可以说明该可逆反应已达平衡状态AD
A.混合气体的密度不再发生改变
B.消耗1molH2O(g)的同时生成1molH2
C.△H不变
D.V正(CO)=V逆(H2)
(2)由总压强P和起始压强P0表示反应体系的总物质的量n总,n总=$\frac{P}{{P}_{0}}$mol;由表中数据计算达到平衡时,反应物H2O(g)的转化率α=79.82%(精确到小数点后第二位)
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能值得氨气,具体流程如下:

①用化学方程式表示整个过程发生的总反应SO2+2H2O=H2SO4+H2
②用化学平行移动的原理分析,在HI分解反应中使用膜反应器分离出H的目的是降低生成物的浓度,使平衡向正方向移动
Ⅲ.(1)将1.0molCH4和2.0molH2O(g)通入容积为100L的反应器,在一定条件下发生反应:
CH4(g)+H2O(g)?CO(g)+3H2(g)测得在一定的压强下CH4的平衡转换率于温度的关系如图1.100℃时该反应的平衡常数为7.2×10-5
(2)在一定温度和压强条件下发生了反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<O,反应达到平衡时,改变温度(T)和压强(P),反应混合物CH3OH“物质的量分数”变化情况如图2所示,关于温度(T)和压强(P)的关系判断准确的是CD(填序号)
A.P3>P2,T3>T2 B.P2>P4,T4>T2 C.P1>P3,T1>T3 D.P1>P4,T1>T4

12.下列实验的现象与对应结论均正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸有脱水性和强氧化性 |
| B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al浓硝酸不反应 |
| C | 将盐酸滴入NaOH溶液 | 无现象 | 盐酸与氢氧化钠不反应 |
| D | 将水蒸气通过灼热铁粉 | 粉末变红 | 铁水在高温下发生反应 |
| A. | A | B. | B | C. | C | D. | D |
9.室温下,0.1mol/L的二元酸H2A溶液中,溶液体系可能存在的含A粒子(H2A、HA-、A2-)所占物质的量分数随pH变化的关系如图所示,下列说法正确的是( )
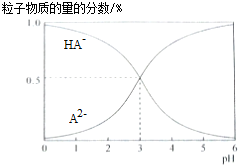

| A. | H2A的电离方程式为:H2A?H++HA- | |
| B. | pH=5时,在NaHA和Na2A的混合溶液中:c(HA-):c(A2-)=1:100 | |
| C. | 等物质的量浓度的NaHA和Na2A溶液等体积混合,离子浓度大小关系为c(Na+)>c(HA-)>c(A2-) | |
| D. | Na2A溶液必存在c(OH-)=c(H+)+c(HA-)+2c(H2A),各粒子浓度均大于0 |
6.下列说法中,正确的是( )
| A. | 芳香烃的分子通式是CnH2n-6 (n≥6) | |
| B. | 苯的同系物是分子中仅含有一个苯环的所有烃类物质 | |
| C. | 苯和甲苯都不能使KMnO4酸性溶液褪色 | |
| D. | 苯和甲苯都能与卤素单质、硝酸等发生取代反应 |
7.将过量铁粉放入硝酸锌和硝酸银的混合溶液中,充分反应后过滤,滤液中的金属离子是( )
| A. | Fe2+ | B. | Fe2+、Zn2+ | C. | Fe2+、Ag+ | D. | Fe2+、Fe3+ |