题目内容
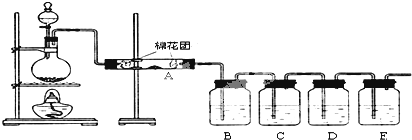
2.废旧显示屏玻璃中含SiO2、Fe2O3、CeO2、FeO等物质.某课题小组以此玻璃粉末为原料,制得Ce(OH)4和硫酸铁铵矾[Fe2(SO4)3•(NH4)2SO4•24H2O],流程设计如下: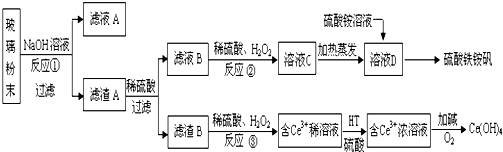
已知:Ⅰ.酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce4+有较强氧化性;
Ⅱ.CeO2不溶于稀硫酸,也不溶于NaOH溶液.
回答以下问题:
(1)反应①的离子方程式是SiO2+2OH-=SiO32-+H2O.
(2)反应②中H2O2的作用是氧化使Fe2+转化为Fe3+.
(3)反应③的离子方程式是2GeO2+6H++H2O2=2Ge3++4H2O+O2↑.
(4)已知有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为:2Ce3+(水层)+6HT(有机层)═2CeT3(有机层)+6H+(水层)
从平衡角度解释:向CeT3 (有机层)加入H2SO4获得较纯的含Ce3+的水溶液的原因是混合液中加入H2SO4使c(H+)增大,平衡向形成Ge3+水溶液方向移动.
(5)硫酸铁铵矾[Fe2(SO4)3•(NH4)2SO4•24H2O]广泛用于水的净化处理,其净水原理用离子方程式解释是Fe3++3H2O=Fe(OH)3+3H+.
(6)相同物质的量浓度的以下三种溶液中,NH4+的浓度由大到小的顺序是a>b>c.
a.Fe2(SO4)3•(NH4)2SO4•24H2O b.(NH4)2SO4 c.(NH4)2CO3.
分析 废玻璃粉末加氢氧化钠溶液后过滤,得到滤渣A的成分是Fe2O3、CeO2、FeO;滤渣A(Fe2O3、CeO2、FeO)加稀硫酸后过滤得滤液B是硫酸亚铁溶液,加入硫酸和氧化剂过氧化氢可生成溶液C中为硫酸铁,所加氧化剂过氧化氢不引入新杂质,加热蒸发得到溶液D为饱和硫酸铁溶液,在溶液中加入硫酸铵溶液得到硫酸铁铵矾;滤渣B的成分是CeO2;CeO2与H2O2和稀H2SO4反应生成Ce3+和O2,加入HT硫酸萃取,将Ce3+从水溶液中萃取出来,Ce3+加碱和氧气发生氧化还原反应生成Ce(OH)4;
(1)反应①是二氧化硅溶于氢氧化钠溶液中生成硅酸钠和水;
(2)反应②中H2O2的作用是沿河亚铁离子为铁离子;
(3)反应③是酸性溶液中CeO2被过氧化氢还原生成Ce3+离子,过氧化氢被氧化生成氧气;
(4)有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为:2Ce3+(水层)+6HT(有机层)═2CeT3(有机层)+6H+(水层),加入硫酸增大氢离子浓度,平衡逆向进行向形成Ge3+水溶液方向移动,获得较纯的含Ce3+的水溶液;
(5)硫酸铁铵矾[Fe2(SO4)3•(NH4)2SO4•24H2O]广泛用于水的净化处理,其净水原理是溶解后溶液中的铁离子水解生成氢氧化铁胶体,胶体具有吸附悬浮杂质的作用,可以净水;
(6)相同物质的量浓度的以下三种溶液中,a.Fe2(SO4)3•(NH4)2SO4•24H2O 溶液中铁离子水解显酸性抑制铵根离子水解,铵根离子浓度增大;
b.(NH4)2SO4 溶液中硫酸根离子对铵根离子水解无影响;
c.(NH4)2CO3,溶液中碳酸根离子水解显碱性促进铵根离子水解,铵根离子浓度减小.
解答 解:废玻璃粉末加氢氧化钠溶液后过滤,得到滤渣A的成分是Fe2O3、CeO2、FeO;滤渣A(Fe2O3、CeO2、FeO)加稀硫酸后过滤得滤液B是硫酸亚铁溶液,加入硫酸和氧化剂过氧化氢可生成溶液C中为硫酸铁,所加氧化剂过氧化氢不引入新杂质,加热蒸发得到溶液D为饱和硫酸铁溶液,在溶液中加入硫酸铵溶液得到硫酸铁铵矾;滤渣B的成分是CeO2;CeO2与H2O2和稀H2SO4反应生成Ce3+和O2,加入HT硫酸萃取,将Ce3+从水溶液中萃取出来,Ce3+加碱和氧气发生氧化还原反应生成Ce(OH)4;
(1)反应①是二氧化硅溶于氢氧化钠溶液中生成硅酸钠和水,反应的离子方程式是SiO2+2OH-=SiO32-+H2O,故答案为:SiO2+2OH-=SiO32-+H2O;
(2)反应②中H2O2的作用是氧化使亚铁离子为铁离子,故答案为:氧化使Fe2+转化为Fe3+;
(3)反应③是酸性溶液中CeO2被过氧化氢还原生成Ce3+离子,过氧化氢被氧化生成氧气,反应的离子方程式2GeO2+6H++H2O2=2Ge3++4H2O+O2↑,
故答案为:2GeO2+6H++H2O2=2Ge3++4H2O+O2↑;
(4)有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为:2Ce3+(水层)+6HT(有机层)═2CeT3(有机层)+6H+(水层),加入硫酸增大氢离子浓度,平衡逆向进行向形成Ge3+水溶液方向移动,获得较纯的含Ce3+的水溶液;
故答案为:混合液中加入H2SO4使c(H+)增大,平衡向形成Ge3+水溶液方向移动;
(5)硫酸铁铵矾[Fe2(SO4)3•(NH4)2SO4•24H2O]广泛用于水的净化处理,其净水原理是溶解后溶液中的铁离子水解生成氢氧化铁胶体,胶体具有吸附悬浮杂质的作用,可以净水,反应的离子方程式为:Fe3++3H2O=Fe(OH)3+3H+,故答案为:Fe3++3H2O=Fe(OH)3+3H+;
(6)相同物质的量浓度的以下三种溶液中,a.Fe2(SO4)3•(NH4)2SO4•24H2O 溶液中铁离子水解显酸性抑制铵根离子水解,铵根离子浓度增大;
b.(NH4)2SO4 溶液中硫酸根离子对铵根离子水解无影响;
c.(NH4)2CO3,溶液中碳酸根离子水解显碱性促进铵根离子水解,铵根离子浓度减小,NH4+的浓度由大到小的顺序是a>b>c,
故答案为:a>b>c.
点评 本题以工艺流程为基础,考查了化学实验基本操作、元素及化合物知识反应等相关知识,提纯制备,为高考常见题型,侧重于学生的分析能力、实验能力和计算能力的考查,注意把握实验的原理和操作方法,题目难度中等.

| 类 别 | 典型代表物名称 | 官能团名称 | 结构简式 |
| 醇 | 乙醇 | 羟基 | CH3CH2OH |
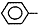
| 酚 | 苯酚 | 羟基 |  |
| 醛 | 乙醛 | 醛基 | CH3CHO |
| 羧酸 | 乙酸 | 羧基 | CH3COOH |
(1)科学家一直致力于“人工固氮”的新方法研究.据报道,在光照条件下,N2在催化剂表面与水发生反应生成NH3和另一种单质.在使用催化剂和不使用催化剂时,该反应过程和能量的变化关系如图所示.
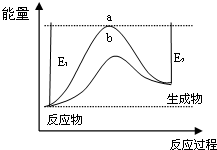
①写出该反应的化学方程式2N2+6H2O$\frac{\underline{\;催化剂\;}}{光照}$4NH3+3O2.
②a和b相比,二者的平衡常数关系是Ka=Kb(填“>”、“=”或“<”).
③升高温度,平衡时NH3的含量增大(填“增大”、“不变”或“减小”).
(2)在 0.5L的密闭容器中,一定量的 N2和H2发生反应:N2(g)+3H2(g)?2NH3(g)△H<0,
400℃时,K=0.5,某一时刻测得N2、H2 和NH3三种物质物质的量分别为2mol、2mol和3mol,则该反应的v正(N2)>v逆(N2)(填“>”“=”或“<”).
(3)将NH3气体通入稀盐酸中,若存在[NH4+]>[Cl-]>[OH-]>[H+]的关系,此时所得溶液的溶质是NH3.H2O、NH4Cl(填化学式).
(4)NH3的催化氧化反应是工业制HNO3的关键步骤,测得某温度下固定容积的容器中的数据为:
| 浓度/mol•L-1 时间 | c(NH3) | c(O2) | c(NO) |
| 0min | 1.000 | 1.600 | 0.000 |
| 2min | 0.600 | a | 0.400 |
| 4min | 0.500 | 0.975 | 0.500 |
| 6min | 0.500 | 0.975 | 0.500 |
| 8min | 0.700 | 1.225 | 0.750 |
②在第8min时改变条件,你认为改变的条件可能是增大NO的浓度.
| t/s | 0 | 3 | 6 | 12 | 24 |
| n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
| A. | 反应在0~3s的平均速率为v(NO2)=0.24mol•L-1•s-1 | |
| B. | 24s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44mol•L-1,则反应的△H<0 | |
| C. | 在T温度下,起始时向容器中充入1.0molNO2、0.5molO3和0.50molN2O5、0.50molO2,反应达到平衡时,压强为起始的0.88倍 | |
| D. | 在T温度下,起始时向容器中充入2.0molN2O5和2.0molO2,达到平衡时,N2O5的转化率大于20% |
| A. | 甲烷与氯气反应:CH4+4Cl2→CCl4+4HCl | |
| B. | 用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 乙醇和钠反应:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ | |
| D. | 苯和浓硝酸、浓硫酸的混合物水浴60℃反应: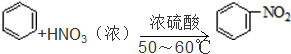 |
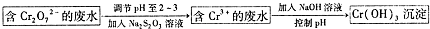
 CH=CH2),聚苯乙烯的化学式为
CH=CH2),聚苯乙烯的化学式为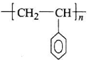 .
.