题目内容
4.将三种黑色粉末组成的混和物加入到100mL 14mol/L某热浓酸中,充分反应后得到蓝绿色溶液和两种气体;将从蓝绿色溶液中分离得到的盐与0.15mol还原铁粉恰好反应完全,可得浅绿色溶液和6.4g红色沉淀;将上述生成的两种气体通入足量饱和NaHCO3溶液中,仍然收集到两种气体,据此推断黑色粉末可能为( )| A. | 物质的量 FeS:CuO:Fe=1:1:1 | |
| B. | 物质的量 C:CuO:Fe=3:2:2 | |
| C. | 质量 MnO2:CuO:C=5.5:8:1.2 | |
| D. | 质量 Fe:C:CuO=7:5:3 |
分析 三种黑色粉末组成的混和物加入到足量的某热浓酸中,充分反应后得到蓝绿色溶液和两种气体,可以确定固体物质中含有铁元素、铜元素,从蓝绿色溶液中分离得到的盐与0.15mol还原铁粉恰好反应完全,可得浅绿色溶液和6.4g红色沉淀,红色沉淀是金属铜,根据元素守恒可以确定含铜物质的量的多少,上述生成的两种气体通入足量饱和NaHCO3溶液中,仍然收集到两种气体,气体可以是物质和碳酸氢钠反应生成的二氧化碳气体和另一种气体,也可以是原来产生的两种气体的保留,根据选项中的物质来确定物质的组成情况.
解答 解:加入0.15 mol Fe,置换出Cu为6.4 g,说明原黑色粉末含CuO为0.1 mol,同时,只需0.1 mol Fe即可,实际上多消耗0.05molFe是和Fe3+反应了.则黑色粉末中含Fe或FeS 0.1 mol,而加入的某酸必为强氧化性酸,浓HNO3或浓H2SO4. 若为浓H2SO4,则产生两种气体只可能是SO2和CO2,但其通过NaHCO3溶液时,则只能得到一种气体CO2,所以某酸只能是浓HNO3.加入浓HNO3产生CO2和NO2,而经过计算知n(CuO)=0.1 mol,n(Fe)=0.1 mol,两者共消耗HNO3为2n(CuO)+6n(Fe)=0.8 mol,则用于和碳反应:HNO3为0.1×14-0.8=0.6 mol,根据HNO3和碳的反应可推知碳应为0.15 mol,所以B正确.
故选B.
点评 本题考查学生物质的性质以及成分的判断,注意元素守恒思想的灵活应用是关键,难度不大.

练习册系列答案
相关题目
17.铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.
Ⅰ、工业上一般以铁矿石、焦炭、石灰石和空气等为原料在高炉中炼制生铁
(1)高炉炼铁过程中加入石灰石的主要目的是将矿石中的二氧化硅等转变为炉渣.
(2)写出在高炉中铁矿石(以磁铁矿为例)被还原成单质铁的化学方程式Fe3O4+4CO$\frac{\underline{\;\;△\;\;}}{\;}$3Fe+4CO2.
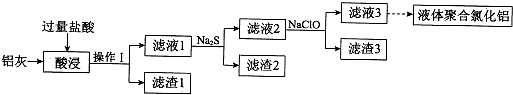
Ⅱ、碱式硫酸铁[Fe(OH)SO4]是一种用语污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(3)写出反应Ⅰ中发生的置换反应的离子方程式Fe+2H+═Fe2++H2↑.
(4)加入少量NaHCO3的目的是调节溶液的pH,应控制pH的范围区间为[4.4~7.5).
(5)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若通入2.8LO2(标准状况),则相当于节约NaNO2的质量为34.5g.
(6)碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe(OH)SO4]2-聚合离子,该水解反应的离子方程式为2[Fe(OH)]2++2H2O═[Fe2(OH)4]2++2H+.
Ⅲ、铁的化合物也是制备高能锂电池的重要材料,已知LiFePO4电池反应为FePO4+Li$\frac{放电}{充电}$LiFePO4,电池中的固体电解质可传到Li+写出该电池充电时阳极反应式LiFePO4-e-═FePO4+Li+,常温下以该电池为电源电解500mL饱和食盐水,当消耗0.35gLi时,溶液的pH值为13(忽略溶液的体积变化).
Ⅰ、工业上一般以铁矿石、焦炭、石灰石和空气等为原料在高炉中炼制生铁
(1)高炉炼铁过程中加入石灰石的主要目的是将矿石中的二氧化硅等转变为炉渣.
(2)写出在高炉中铁矿石(以磁铁矿为例)被还原成单质铁的化学方程式Fe3O4+4CO$\frac{\underline{\;\;△\;\;}}{\;}$3Fe+4CO2.
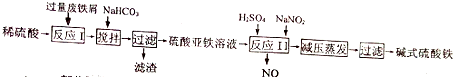
Ⅱ、碱式硫酸铁[Fe(OH)SO4]是一种用语污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁)生产碱式硫酸铁的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(4)加入少量NaHCO3的目的是调节溶液的pH,应控制pH的范围区间为[4.4~7.5).
(5)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若通入2.8LO2(标准状况),则相当于节约NaNO2的质量为34.5g.
(6)碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe(OH)SO4]2-聚合离子,该水解反应的离子方程式为2[Fe(OH)]2++2H2O═[Fe2(OH)4]2++2H+.
Ⅲ、铁的化合物也是制备高能锂电池的重要材料,已知LiFePO4电池反应为FePO4+Li$\frac{放电}{充电}$LiFePO4,电池中的固体电解质可传到Li+写出该电池充电时阳极反应式LiFePO4-e-═FePO4+Li+,常温下以该电池为电源电解500mL饱和食盐水,当消耗0.35gLi时,溶液的pH值为13(忽略溶液的体积变化).
12.下列实验的现象与对应结论均正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸有脱水性和强氧化性 |
| B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al浓硝酸不反应 |
| C | 将盐酸滴入NaOH溶液 | 无现象 | 盐酸与氢氧化钠不反应 |
| D | 将水蒸气通过灼热铁粉 | 粉末变红 | 铁水在高温下发生反应 |
| A. | A | B. | B | C. | C | D. | D |
9.室温下,0.1mol/L的二元酸H2A溶液中,溶液体系可能存在的含A粒子(H2A、HA-、A2-)所占物质的量分数随pH变化的关系如图所示,下列说法正确的是( )
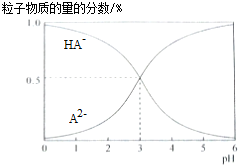

| A. | H2A的电离方程式为:H2A?H++HA- | |
| B. | pH=5时,在NaHA和Na2A的混合溶液中:c(HA-):c(A2-)=1:100 | |
| C. | 等物质的量浓度的NaHA和Na2A溶液等体积混合,离子浓度大小关系为c(Na+)>c(HA-)>c(A2-) | |
| D. | Na2A溶液必存在c(OH-)=c(H+)+c(HA-)+2c(H2A),各粒子浓度均大于0 |
16.已知:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应.相关数据如下:下列说法中,不正确的是( )
| 容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
| CO | H2O | CO2 | H2 | ||
| ① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
| ② | 0 | 0 | 1 | 4 | 热量变化:Q |
| A. | 容器①中反应达平衡时,CO的转化率为80% | |
| B. | 容器①中CO的转化率等于容器②中CO2的转化率 | |
| C. | 容器①中CO反应速率等于H2O的反应速率 | |
| D. | 平衡时,两容器中CO2的浓度相等 |