4.T1温度时,向密闭容器中通入N2O5,发生以下反应:2N2O5(g)?4NO3(g)+O2(g)△H>0,部分实验数据简下表下列说法中不正确的是( )
| 时间/s | 0 | 50 | 100 | 150 |
| c(N2O5)/mol.L-1 | 2.50 | 1.76 | 1.25 | 1.25 |
| A. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2 | |
| B. | 50s内N2O5分解速率为1.48×10-2mol.L-1.s-1 | |
| C. | T1温度下的平衡常数为K1=15.625,平衡时N2O5的转化率为50% | |
| D. | 达到平衡后其他 条件不变,将容器的体积压缩到原来的$\frac{1}{2}$,则c(N2O5)>2.50mol.L-1 |
3.常见的离子晶体类型有多种,如图是其中一种空间构型,则该晶体中X、Y的离子个数之比可能为( )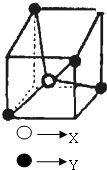

| A. | YX4 | B. | YX2 | C. | YX | D. | XY4 |
2.900℃时,向2.0L恒容密闭容器中充入0.40mol乙苯,发生反应:
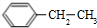 (g)?
(g)?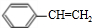 (g)+H2(g)△H=a kJ•mol-1.经一段时间后达到平衡.反应过程中测定的部分数据见下表:下列说法正确的是( )
(g)+H2(g)△H=a kJ•mol-1.经一段时间后达到平衡.反应过程中测定的部分数据见下表:下列说法正确的是( )
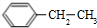 (g)?
(g)? (g)+H2(g)△H=a kJ•mol-1.经一段时间后达到平衡.反应过程中测定的部分数据见下表:下列说法正确的是( )
(g)+H2(g)△H=a kJ•mol-1.经一段时间后达到平衡.反应过程中测定的部分数据见下表:下列说法正确的是( )| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
| A. | 反应在前20 min的平均速率为v(H2)=0.004mol•L-1•min-1 | |
| B. | 保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08mol•L-1,则a<0 | |
| C. | 保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率为50.0% | |
| D. | 相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2,达到平衡前v(正)>v(逆) |
1.反应:xA(气)+yB(气)?zC(气),达到平衡时测得A气体的浓度为0.5mol•L-1,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3mol•L-1,则下列叙述正确的是( )
| A. | C的质量分数降低 | B. | 平衡向右移动 | C. | B的转化率升高 | D. | x+y<z |
20.一定条件下,体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.3mol Z.下列说法正确的是( )
| A. | 以X浓度变化表示的反应速率为0.001 mol/(L•s) | |
| B. | 将容器体积变为20 L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 其他条件不变时,若增大压强,则物质Y的转化率减小 | |
| D. | 其他条件不变时,若升高温度,X的体积分数增大,则该反应的△H>0 |
19. 汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:
汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)2NO(g)+2CO(g)≒2CO2(g)+N2(g)△H=-746.5KJ/mol (条件为使用催化剂)
已知:
2C (s)+O2(g)≒2CO(g)△H=-221.0KJ/mol
C (s)+O2(g)≒CO2(g)△H=-393.5KJ/mol
则N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1.
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
①c1合理的数值为D.(填字母标号)
A.4.20 B.4.00 C.3.50 D.2.50
②根据①中数据计算前2s内的平均反应速率v(CO2)=3.75×10-4 mol/(L.s).
③不能作为判断该反应达到平衡状态的标志是ab.(填字母标号)
a.2v正(CO)=v逆(N2)
b.容器中混合气体的密度保持不变
c.容器中气体的压强不变
d.CO2的体积分数不变
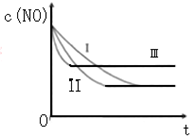
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如如图所示:
则曲线Ⅰ、Ⅱ、Ⅲ对应的实验编号依次为③②①.
(4)已知:CO通入新制的银氨溶液中可生成银镜,同时释放一种能使湿润的红色石蕊试纸变蓝的气体.某温度下,向1L密闭容器中充入1molNO和1molCO,反应达到平衡后,将平衡混合气体通入足量新制的银氨溶液中,生成43.2g Ag,则该温度下,反应2NO(g)+2CO(g)≒2CO2(g)+N2(g)(条件为使用催化剂)的化学平衡常数K=160.
(5)CO可作燃料电池的燃气.用Li2CO3和Na2CO3的熔融盐混合物做电解质,空气与CO2的混合气为正极助燃气,制得650°C下工作的燃料电池.该电池总反应方程式为2CO+O2=2CO2 则负极反应式为2CO+2CO32--4e-═4CO2.
 汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:
汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:(1)2NO(g)+2CO(g)≒2CO2(g)+N2(g)△H=-746.5KJ/mol (条件为使用催化剂)
已知:
2C (s)+O2(g)≒2CO(g)△H=-221.0KJ/mol
C (s)+O2(g)≒CO2(g)△H=-393.5KJ/mol
则N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1.
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(CO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
A.4.20 B.4.00 C.3.50 D.2.50
②根据①中数据计算前2s内的平均反应速率v(CO2)=3.75×10-4 mol/(L.s).
③不能作为判断该反应达到平衡状态的标志是ab.(填字母标号)
a.2v正(CO)=v逆(N2)
b.容器中混合气体的密度保持不变
c.容器中气体的压强不变
d.CO2的体积分数不变
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如如图所示:
| 实验 编号 | T/°C | NO初始浓 度/10-3mol•L-1 | CO初始浓 度/10-3mol•L-1 | 催化剂的比 表面积/m2•g-1 |
| ① | 350 | 1.20 | 5.80 | 124 |
| ② | 280 | 1.20 | 5.80 | 124 |
| ③ | 280 | 1.20 | 5.80 | 82 |
(4)已知:CO通入新制的银氨溶液中可生成银镜,同时释放一种能使湿润的红色石蕊试纸变蓝的气体.某温度下,向1L密闭容器中充入1molNO和1molCO,反应达到平衡后,将平衡混合气体通入足量新制的银氨溶液中,生成43.2g Ag,则该温度下,反应2NO(g)+2CO(g)≒2CO2(g)+N2(g)(条件为使用催化剂)的化学平衡常数K=160.
(5)CO可作燃料电池的燃气.用Li2CO3和Na2CO3的熔融盐混合物做电解质,空气与CO2的混合气为正极助燃气,制得650°C下工作的燃料电池.该电池总反应方程式为2CO+O2=2CO2 则负极反应式为2CO+2CO32--4e-═4CO2.
17.随着环保意识增强,清洁能源越来越受到人们关注.甲烷是一种较为理想的洁净燃料.以下是利用化学反应原理中的有关知识对甲烷转化问题的研究.
(1)已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-802.3kJ•mol-1
H2O(l)═H2O(g),△H=+44.0kJ•mol-1
则1.6g甲烷气体完全燃烧生成液态水,放出热量为89.03kJ.
(2)利用甲烷与水反应制备氢气,因原料廉价,具有推广价值.该反应可表示为CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.1kJ•mol-1.为了探究温度、压强对上述化学反应速率的影响,某同学设计了以下三组对比实验(温度为360℃或480℃、压强为101kPa或303kPa,其余实验条件见下表).
表中t=480,p=303;设计实验2、3的目的是探究温度对化学反应速率的影响.实验1、2、3中反应的化学平衡常数的大小关系是K2>K1=K3(用K1、K2、K3表示).
(3)若800℃时,反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.1kJ•mol-1的平衡常数(K)=1.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如下表:
则此时正、逆反应速率的关系是C(填标号)
A.v(正)<v(逆) B.v(正)=v(逆) C.v(正)>v(逆) D.无法判断.
(1)已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-802.3kJ•mol-1
H2O(l)═H2O(g),△H=+44.0kJ•mol-1
则1.6g甲烷气体完全燃烧生成液态水,放出热量为89.03kJ.
(2)利用甲烷与水反应制备氢气,因原料廉价,具有推广价值.该反应可表示为CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.1kJ•mol-1.为了探究温度、压强对上述化学反应速率的影响,某同学设计了以下三组对比实验(温度为360℃或480℃、压强为101kPa或303kPa,其余实验条件见下表).
| 实验序号 | 温度/℃ | 压强/kPa | CH4初始浓度/mol•L-1 | H2O初始浓度/mol•L-1 |
| 1 | 360 | p | 2.00 | 6.80 |
| 2 | t | 101 | 2.00 | 6.80 |
| 3 | 360 | 101 | 2.00 | 6.80 |
(3)若800℃时,反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.1kJ•mol-1的平衡常数(K)=1.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如下表:
| CH4 | H2O | CO | H2 |
| 3.0mol•L-1 | 8.5mol•L-1 | 2.0mol•L-1 | 2.0mol•L-1 |
A.v(正)<v(逆) B.v(正)=v(逆) C.v(正)>v(逆) D.无法判断.
16.某温度下,将2mol A和1mol B放入一密闭容器中,发生反应:A(g)+B(g)?2C(s)+2D(g),5min后反应达到平衡,测得生成C为0.8mol,下列相关表述正确的是( )
0 167181 167189 167195 167199 167205 167207 167211 167217 167219 167225 167231 167235 167237 167241 167247 167249 167255 167259 167261 167265 167267 167271 167273 167275 167276 167277 167279 167280 167281 167283 167285 167289 167291 167295 167297 167301 167307 167309 167315 167319 167321 167325 167331 167337 167339 167345 167349 167351 167357 167361 167367 167375 203614
| A. | 该反应的化学平衡常数表达式是K=$\frac{{c}^{2}(C)•{c}^{2}(D)}{c(A)•c(B)}$ | |
| B. | 若向平衡体系中加入少量生成物C,则正、逆反应速率均增大 | |
| C. | 增大该体系的压强,A的转化率增大 | |
| D. | 该条件下B的平衡转化率是40% |
 研究碳及其化合物的性质对于科研、生产生活具有重要意义.
研究碳及其化合物的性质对于科研、生产生活具有重要意义.