题目内容
18. 研究碳及其化合物的性质对于科研、生产生活具有重要意义.
研究碳及其化合物的性质对于科研、生产生活具有重要意义.(1)将1.8g木炭置于2.24L(标准状况)氧气中完全燃烧,至反应物耗尽,测得放出热量30.65kJ,则反应过程中共转移电子0.4mol.已知:C(s)+O2(g)=CO2(g)△H=-392.0kJ•mol-1综合上述信息,请写出CO完全燃烧的热化学方程式CO(g)+1212O2(g)=CO2(g)△H=-281.5kJ/mol.
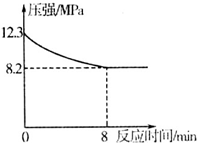
(2)CO可以合成工业用洁净燃料甲醇,反应为:CO(g)+2H2(g)?CH3OH(g)△H<0.T0℃时,向容积均为50mL密闭容器甲、乙中分别加入1mol CO和2mol H2,发生上述反应,其中乙为绝热容器,反应过程中测得甲容器内压强随时间变化曲线如图所示:
①下列描述中能说明甲容器中的反应达平衡状态的是bd(填序号).
a.2v正(H2)=v逆(CH3OH)
b.CO与CH3OH的体积比不再改变
c.化学平衡常数K的值不再变化
d.CO、H2、CH3OH的浓度均不再变化
②0-8分钟内,甲中v(H2)=2.5mol•L-1•min-1;达到平衡后,甲中CO的转化率大于(填写“大于”、“小于”或“等于”)乙中CO的转化率.
分析 (1)碳的物质的量为1.8g12g/mol1.8g12g/mol=0.15mol,氧气物质的量为2.24L22.4L/mol2.24L22.4L/mol=0.1mol,二者完全反应,而C、O原子数目之比为0.15:0.1×2=3:4,介于1:2与1:1之间,故反应生成CO、CO2,根据碳原子、氧原子守恒列方程计算CO、CO2的物质的量,根据O元素化合价变价计算转移电子物质的量;
根据热化学方程式计算1.8g碳燃烧生成二氧化碳放出的热量,与实际热量之差为生成的CO燃烧放出的热量,注明聚集状态与反应热书写热化学方程式;
(2)①可逆反应到达平衡时,同一物质的正逆反应速率相等,各组分的浓度、含量不变,由此衍生的一些其它量不变,判断平衡状态的物理量应随反应进行发生变化,当该物理量由变化到不变化,说明到达平衡;
②恒温恒容下,压强之比等于气体物质的量之比,据此计算平衡时混合气体总物质的量,再利用差量法计算参加反应的氢气的物质的量,根据v=△c△t△c△t计算v(H2);
乙为绝热容器,正反应为放热反应,随反应进行,乙中温度升高,乙到达的平衡相当于在甲平衡的基础上升高温度,升高温度,平衡向逆反应方向移动.
解答 解:(1)碳的物质的量为1.8g12g/mol1.8g12g/mol=0.15mol,氧气物质的量为2.24L22.4L/mol2.24L22.4L/mol=0.1mol,二者完全反应,而C、O原子数目之比为0.15:0.1×2=3:4,介于1:2与1:1之间,反应生成CO、CO2,反应中氧元素化合价由0价降低为-2价,故转移电子为0.1mol×2×2=0.4mol;
设CO、CO2的物质的量分别为xmol、ymol,根据碳原子、氧原子守恒,则:
{x+y=0.15x+2y=0.1×2
解得x=0.1 y=0.05
若0.15mol碳完全燃烧生成二氧化碳,则放出的热量为0.15mol×392.0kJ/mol=58.8kJ,而生成0.1molCO、0.05molCO2放出的热量为30.65kJ,根据盖斯定律,可知0.1molCO燃烧生成二氧化碳放出的热量为58.8kJ-30.65kJ=28.15kJ,则1molCO燃烧放出的热量为281.5kJ,故CO燃烧的热化学方程式为:CO(g)+12O2(g)=CO2(g)△H=-281.5kJ/mol,
故答案为:0.4;CO(g)+12O2(g)=CO2(g)△H=-281.5kJ/mol;
(2)①a.若2v正(H2)=v逆(CH3OH),则v正(H2):v逆(CH3OH)=1:2,不等于化学计量数之比2:1,故逆反应速率较快,反应向逆反应进行,故a错误;
b.随反应进行CO与CH3OH的体积比减小,二者体积之比不再改变,说明反应到达平衡,故b正确;
c.温度不变,化学平衡常数K的值始终不变,不能说明得到平衡,故c错误;
d.CO、H2、CH3OH的浓度均不再变化,反应混合物个组分的浓度不变,说明反应到达平衡,故d正确,
故选:bd;
②恒温恒容下,压强之比等于气体物质的量之比,设甲中平衡时总物质的量为xmol,则(1mol+2mol):xmol=12.3:8.2,解得x=2,
CO(g)+2H2(g)?CH3OH(g)物质的量减少
2 2
1mol (1mol+2mol)-2mol=1mol
故v(H2)=1mol0.05L8min=2.5mol/(L.min);
乙为绝热容器,正反应为放热反应,随反应进行,乙中温度升高,乙到达的平衡相当于在甲平衡的基础上升高温度,升高温度,平衡向逆反应方向移动,故甲中CO的转化率大于乙中CO的转化率,
故答案为:2.5;大于.
点评 本题考查化学平衡有关计算、化学平衡移动、化学平衡状态判断、热化学方程式书写等,(1)注意利用盖斯定律计算CO燃烧放出的热量,(2)中注意乙装置为绝热容器,难度中等.

| A. | 电石气 | B. | 甲烷 | C. | 尿素 | D. | 醋酸 |
| A. | 硫酸是铅蓄电池的电解质溶液,铅蓄电池可实现化学能转变成电能 | |
| B. | 硅酸干凝胶是硅酸干燥剂的主要成分,作用是吸收水分 | |
| C. | 肥皂的主要成分是硬脂酸钠,可以用于除去油污 | |
| D. | 二氧化硅是光能转化为电能的转化材料 |
(1)下面表格中的数据(铁和铜的某些物理数据)摘自某化学手册.
| 金属 | 颜色 | 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 比热[KJ/kg•℃] |
| Fe | 银白色 | 7.86 | 1 535 | 2 750 | 0.44 |
| Cu | 红色 | 8.92 | 1 083 | 2 567 | 0.38 |
(2)考古中出土的青铜器、铁剑等往往锈迹斑斑.请完成下面铜、铁制品在自然条件下发生锈蚀的化学方程式:
①□Cu+□O2+□H2O+□CO2═□Cu2(OH)2CO3
②□Fe+□O2+□H2O═□Fe2O3•nH2O
(3)镁、铝是现代人常用的金属材料,这些活泼金属的冶炼方法是电解法,工业生产中,镁的冶炼采用的反应物是熔融氯化镁(或MgCl2),铝的冶炼采用的反应物是熔融氧化铝(或Al2O3).
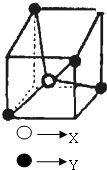
| A. | YX4 | B. | YX2 | C. | YX | D. | XY4 |
(1)科学家一直致力于“人工固氮”的新方法研究.据报道,在光照条件下,N2在催化剂表面与水发生反应生成NH3和另一种单质.在使用催化剂和不使用催化剂时,该反应过程和能量的变化关系如图所示.
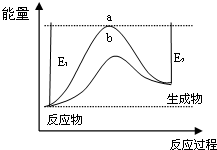
①写出该反应的化学方程式2N2+6H2O催化剂_光照4NH3+3O2.
②a和b相比,二者的平衡常数关系是Ka=Kb(填“>”、“=”或“<”).
③升高温度,平衡时NH3的含量增大(填“增大”、“不变”或“减小”).
(2)在 0.5L的密闭容器中,一定量的 N2和H2发生反应:N2(g)+3H2(g)?2NH3(g)△H<0,
400℃时,K=0.5,某一时刻测得N2、H2 和NH3三种物质物质的量分别为2mol、2mol和3mol,则该反应的v正(N2)>v逆(N2)(填“>”“=”或“<”).
(3)将NH3气体通入稀盐酸中,若存在[NH4+]>[Cl-]>[OH-]>[H+]的关系,此时所得溶液的溶质是NH3.H2O、NH4Cl(填化学式).
(4)NH3的催化氧化反应是工业制HNO3的关键步骤,测得某温度下固定容积的容器中的数据为:
| 浓度/mol•L-1 时间 | c(NH3) | c(O2) | c(NO) |
| 0min | 1.000 | 1.600 | 0.000 |
| 2min | 0.600 | a | 0.400 |
| 4min | 0.500 | 0.975 | 0.500 |
| 6min | 0.500 | 0.975 | 0.500 |
| 8min | 0.700 | 1.225 | 0.750 |
②在第8min时改变条件,你认为改变的条件可能是增大NO的浓度.
| A. | CH4高温→C+2H2 | |
| B. | CH3CH=CH2+Br2CCl4→CH3CHBrCH2Br | |
| C. | CH4+2O2点燃→CO2+2H2O | |
| D. | C2H6+Cl2光→C2H5Cl+HCl |

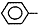 CH=CH2),聚苯乙烯的化学式为
CH=CH2),聚苯乙烯的化学式为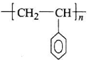 .
.