19.关于元素周期表和元素周期律的应用有如下叙述:其中正确的是( )
①元素周期表是同学们学习化学知识的一种重要工具;
②利用元素周期表可以预测新元素的原子结构和性质;
③利用元素周期表和元素周期律可以预言新元素;
④利用元素周期表可以指导寻找某些特殊的材料.
①元素周期表是同学们学习化学知识的一种重要工具;
②利用元素周期表可以预测新元素的原子结构和性质;
③利用元素周期表和元素周期律可以预言新元素;
④利用元素周期表可以指导寻找某些特殊的材料.
| A. | ①②③④ | B. | ②③④ | C. | ③④ | D. | ②③ |
17.按系统命名法命名时,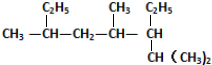 的主链碳原子数是( )
的主链碳原子数是( )
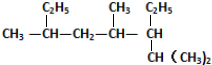 的主链碳原子数是( )
的主链碳原子数是( )| A. | 5 | B. | 6 | C. | 7 | D. | 8 |
16.下列说法正确的是( )
| A. | 任何化学反应都伴有能量变化 | |
| B. | 化学反应中的能量变化都表现为热量变化 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 反应物的总能量高于生成物的总能量时,发生吸热反应 |
15.下列说法正确的是( )
| A. | 金属元素A的单质不能把金属元素B从它的盐溶液中置换出来,一定可以说明金属性:A<B | |
| B. | 根据反应2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,可说明C的非金属性比Si强 | |
| C. | 周期表中第n周期第n主族的元素均为金属 | |
| D. | 按照元素周期表的排布规律,非金属元素最多为23种 |
14.X、Y是短周期元素,两者能形成化合物X2Y3,已知X的核电荷数为n,则Y的核电荷数不可能是( )
| A. | n+11 | B. | n+1 | C. | n+3 | D. | n+4 |
13.有关短周期元素叙述正确的是( )
| A. | 所有元素均为主族元素 | |
| B. | 金属元素的有7种 | |
| C. | 13号元素的最高价氧化物既能溶于强酸又能溶于强碱 | |
| D. | 8号元素的氢化物中所有原子都满足最外层8电子结构 |
11.下列实验一定能获得成功的是( )
0 167148 167156 167162 167166 167172 167174 167178 167184 167186 167192 167198 167202 167204 167208 167214 167216 167222 167226 167228 167232 167234 167238 167240 167242 167243 167244 167246 167247 167248 167250 167252 167256 167258 167262 167264 167268 167274 167276 167282 167286 167288 167292 167298 167304 167306 167312 167316 167318 167324 167328 167334 167342 203614
| A. | 溴乙烷中加入足量NaOH溶液加热,然后冷却,再加入AgNO3溶液有浅黄色沉淀生成 | |
| B. | 蔗糖溶液中加入稀H2SO4微热,再加少量新制Cu(OH)2浊液煮沸,有红色沉淀生成 | |
| C. | 将红色铜丝在酒精灯上加热后,立即插入无水乙醇中,铜丝恢复成原来的红色 | |
| D. | 用分液漏斗直接分离乙醇和苯的混合液 |
