题目内容
16.下列说法正确的是( )| A. | 任何化学反应都伴有能量变化 | |
| B. | 化学反应中的能量变化都表现为热量变化 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 反应物的总能量高于生成物的总能量时,发生吸热反应 |
分析 A.旧键断裂吸收能量,新键形成放出能量;
B.化学反应的能量可转化为为热能、光能、电能、机械能等;
C.化学反应是否加热才能进行与反应热无关;
D.反应物的总能量高于生成物的总能量时,发生放热反应.
解答 解:A.旧键断裂吸收能量,新键形成放出能量,化学反应有化学键的断裂和形成,都伴有能量变化,故A正确;
B.化学反应的能量可转化为为热能、光能、电能、机械能等,不一定表现为热能,如可燃物的燃烧,既转化为热能,又有光能,故B错误;
C.铝热反应在高温下才能进行,但属于放热反应,故C错误;
D.反应物的总能量高于生成物的总能量时,发生放热反应,故D错误.
故选A.
点评 本题考查化学反应与能量问题,题目难度不大,注意化学能与其它能量的转化形式.

练习册系列答案
相关题目
6.分别在pH=1的酸和pH=14的NaOH溶液中加入足量的铝,放出H2的量前者多,其原因可能是( )
①两溶液的体积相同,酸是多元强酸
②两溶液的体积相同,酸是一元弱酸
③酸溶液的体积大于NaOH溶液的体积
④酸是强酸,浓度比NaOH溶液的大.
①两溶液的体积相同,酸是多元强酸
②两溶液的体积相同,酸是一元弱酸
③酸溶液的体积大于NaOH溶液的体积
④酸是强酸,浓度比NaOH溶液的大.
| A. | ①② | B. | ② | C. | ②③ | D. | ④ |
4.某研究小组为探究氯酸钾受热分解反应中的催化剂效果,在相同条件下,使用不同催化剂测量产生等量气体时所需时间,并回收催化剂,结果如下:
(1)根据实验原理,所选仪器带铁夹的铁架台、大试管(含带橡皮塞的导管)、量气装置、过滤装置、电子天平外,还必需的仪器有酒精灯、计时器(或秒表).
(2)写出实验①的化学方程式2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,根据表中信息,若实验室中无MnO2可选用上述催化剂中的Fe2O3(填化学式)代替也可基本达到同样的催化效果.
(3)实验②中的KClO3分解率为40.8%(保留一位小数).
(4)实验④中发现有刺激性气味的气体单质产生,请完成以下探究活动:
| 实验编号 | KCIO3(g) | 催化剂 | 产生气体(mL) (已折算到标准情况) | 耗时(S) | ||
| 化学式 | 质量(g) | 回收 | ||||
| ① | 0.60 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
| ② | 0.60 | CuO | 0.20 | 90% | 67.2 | 79.5 |
| ③ | 0.60 | Fe2O3 | 0.20 | 90% | 67.2 | 34.7 |
| ④ | 0.60 | Cr2O3 | 0.20 | 异常 | 67.2 | 188.3 |
(2)写出实验①的化学方程式2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,根据表中信息,若实验室中无MnO2可选用上述催化剂中的Fe2O3(填化学式)代替也可基本达到同样的催化效果.
(3)实验②中的KClO3分解率为40.8%(保留一位小数).
(4)实验④中发现有刺激性气味的气体单质产生,请完成以下探究活动:
| 提出猜想 | 该刺激性气味的气体单质可能是Cl2 |
| 设计实验 验证猜想 | 实验步骤和结论(不要求写具体操作过程)将燃着的小木条插进集气瓶中,直至木条熄灭,用玻璃棒粘着湿润的碘化钾淀粉试纸插进集气瓶中.若试纸变蓝则证明是Cl2,否则不是氯气: |
11.下列实验一定能获得成功的是( )
| A. | 溴乙烷中加入足量NaOH溶液加热,然后冷却,再加入AgNO3溶液有浅黄色沉淀生成 | |
| B. | 蔗糖溶液中加入稀H2SO4微热,再加少量新制Cu(OH)2浊液煮沸,有红色沉淀生成 | |
| C. | 将红色铜丝在酒精灯上加热后,立即插入无水乙醇中,铜丝恢复成原来的红色 | |
| D. | 用分液漏斗直接分离乙醇和苯的混合液 |
1.化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
| A. | HCl的电子式H:Cl | B. | HClO的结构式H-Cl-O | ||
| C. | Cl-的结构示意图 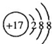 | D. | 质量数为37的氯原子${\;}_{17}^{37}Cl$ |
5.元素的性质呈周期性变化的根本原因是( )
| A. | 随着元素相对原子质量的递增,量变引起质变 | |
| B. | 元素的原子半径呈周期性变化 | |
| C. | 元素原子的核外电子排布呈周期性变化 | |
| D. | 元素的金属性和非金属性呈周期性变化. |
 (1)某学生设计的用该浓盐酸与二氧化锰反应制取并收集干燥纯净的氯气的装置如图:
(1)某学生设计的用该浓盐酸与二氧化锰反应制取并收集干燥纯净的氯气的装置如图: