题目内容
15.下列说法正确的是( )| A. | 金属元素A的单质不能把金属元素B从它的盐溶液中置换出来,一定可以说明金属性:A<B | |
| B. | 根据反应2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,可说明C的非金属性比Si强 | |
| C. | 周期表中第n周期第n主族的元素均为金属 | |
| D. | 按照元素周期表的排布规律,非金属元素最多为23种 |
分析 A、钠与硫酸铜溶液反应不能置换出铜,但金属钠比铜活泼;
B、元素的非金属性是指元素的原子得电子的能力,当元素得电子的时候相当于化合价降级(例如由正1价到0),也就是被还原;
C、氢是第一周期第ⅠA元素;
D、按照元素周期表的排布规律,非金属元素在周期表中的数目以此为2、6、5、4、3、2、1.
解答 解:A、钠与硫酸铜溶液反应不能置换出铜,但金属钠比铜活泼,所以不可以说明A的金属性一定小于B,故A错误;
B、元素的非金属性是指元素的原子得电子的能力,当元素得电子的时候相当于化合价降级(例如由正1价到0),也就是被还原,碳是失电子而硅得电子,所以不能说明C的非金属性比Si强,故B错误;
C、氢是第一周期第ⅠA元素,但是非金属元素,故C错误;
D.按照元素周期表的排布规律,非金属元素在周期表中的数目以此为2、6、5、4、3、2、1,共23种,故D正确.
故选D.
点评 本题综合考查元素周期表、元素周期律知识,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
5.将0.1mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体时都会引起( )
| A. | CH3COOH电离程度变大 | B. | 溶液pH减小 | ||
| C. | 溶液的导电能力减弱 | D. | 溶液中c(H+)减小 |
6.有一未知浓度的稀硫酸25mL,先加入25mL5mol/LBaCl2溶液后,改加NaOH溶液,结果用去1.0mol/LNaOH溶液25mL恰好完全中和.则稀硫酸的物质的量浓度为( )
| A. | 0.5mol/L | B. | 1.0mol/L | C. | 1.5mol/L | D. | 2.0mol/L |
4.用下列实验装置和方法进行相应的实验,不能达到实验目的是( )


| A. | 用图1装置和方法测定一定时间内生成H2的反应速率 | |
| B. | 用图2装置和方法进行C02喷泉实验 | |
| C. | 用图3装装置和方法除去氯气中的氯化氢 | |
| D. | 用图4装置和方法比较Na2C03与NaHC03热稳定性 |
2.电解CuCl2溶液时,如果阴极上有1.6g铜析出,则阳极上产生气体的体积(标准状况)约为( )
| A. | 0.28 L | B. | 0.56 L | C. | 0.14 L | D. | 11.2 L |

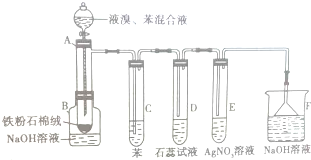 如图为探讨苯和液溴反应改进的实验装置图,其中A为具支试管改制成的反应容器,在其下端开了一个小孔,并塞好石棉绒,实验时先加少量铁粉于石棉绒上,填写下列空白:
如图为探讨苯和液溴反应改进的实验装置图,其中A为具支试管改制成的反应容器,在其下端开了一个小孔,并塞好石棉绒,实验时先加少量铁粉于石棉绒上,填写下列空白: