题目内容
18.(1)经元素分析后,发现某烃的含碳量为82.76%,氢的质量分数则为17.24%,且相对分子质量为58,该烃的分子式C4H10(2)某种苯的同系物0.1mol在足量的氧气中完全燃烧,将产生的高温气体依次通过浓硫酸和氢氧化钠溶液,使浓硫酸增重7.2g,氢氧化钠溶液增重30.8g.推测它的分子式C7H8和结构简式
(3)某含氧有机物,它的相对分子质量为46.O,碳的质量分数为52.2%,氢的质量分数为33.0%,NMR中只有一个信号,请写出其结构简式CH3OCH3.
(4)某有机化合物仅由碳、氢、氧三种元素组成,经测定其相对分子质量为90.称取该有机物样品1.8g,在足量纯氧中完全燃烧,将产物先后通过浓硫酸和碱石灰,两者分别增重1.08g和2.64g.该有机物的分子式C3H6O3.
分析 (1)碳的质量分数是82.76%,氢的质量分数是17.24%,则可以计算该物质中碳、氢原子个数之比据此写出实验式;根据相对分子质量为58,可以确定分子式;
(2)根据相对氢气的密度计算出A的相对分子量;浓硫酸增重的为水的质量,氢氧化钠增重的为二氧化碳的质量,根据n=$\frac{m}{M}$计算出水、二氧化碳的物质的量,从而得出芳香烃的分子中含有的C、H原子数,确定其的分子式及结构简式;
(3)根据元素的质量分数和相对分子质量为46可以确定原子数目,然后确定其分子式,然后NMR中只有一个信号,确定其结构,写出其结构简式;
(4)根据有机物的质量和相对分子质量可计算有机物的物质的量,根据生成的水和二氧化碳的质量可计算有机物中含有的C、H原子个数,结合相对分子质量可计算O原子个数,进而可求得分子式.
解答 解:(1)碳的质量分数是82.76%,氢的质量分数是17.24%,则该物质中碳、氢原子个数之比为;$\frac{82.76%}{12}:\frac{17.24%}{1}$=2:5,该烃的实验式是C2H5,相对分子质量为58,则分子式C4H10,故答案为:C4H10;
(2)某芳香烃A的蒸气对H2的相对密度为46,则A的相对分子质量为46×2=92,A完全燃烧生成的气体通过浓硫酸和氢氧化钠时,浓硫酸吸收水蒸气,氢氧化钠吸收二氧化碳,故0.1molA燃烧生成水7.2g、二氧化碳30.8g,则n(H2O)=$\frac{7.2g}{18g/mol}$=0.4mol,根据原子守恒知,n(H)=2n(H2O)=0.8mol,n(CO2)=$\frac{30.8g}{44g/mol}$=0.7mol,所以n(A):n(C):n(H)=0.1mol:0.7mol:0.8mol=1:7:8,A的分子式为:C7H8,其结构简式为 ,
,
故答案为:C7H8, ;
;
(3)该有机物X碳的质量分数为52.2%,氢的质量分数为13.0%,则氧元素的质量分数为:1-52.2%-13.0%=34.8%,则X中C、H、O原子的个数之比为:$\frac{52.2%}{12}$:$\frac{13.0%}{1}$:$\frac{34.8%}{16}$=2:6:1,该有机物的最简式为C2H6O,最简式的式量为46,X的相对分子量为46,则X的最简式就是其分子式,NMR中只有一个信号,则结构中只有一种氢,所以结构简式为:CH3OCH3,故答案为:CH3OCH3;
(4)设有机物的分子式为CXHYOz,
n(CXHYOz)=$\frac{1.8g}{90g/mol}$=0.02mol,
n(H2O)=$\frac{1.08g}{18g/mol}$=0.06mol,
n(CO2)=$\frac{2.64g}{44g/mol}$=0.06mol,
所以x=3,y=6.
又因为有机物分子量为90,则有机物中O原子数为$\frac{90-12×3-1×6}{16}$=3,z=3,
故推得有机物分子式为C3H6O3,
故答案为:C3H6O3.
点评 本题考查了有机物分子式、结构式的确定,题目难度中等,注意掌握确定有机物分子式的方法,明确同分异构体的概念及书写方法,试题培养了学生灵活应用所学知识的能力.

| A. | AlCl3溶液和NaAlO2溶液分别加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同 | |
| B. | 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度 | |
| C. | 用加热煮沸的方法可除去KNO3溶液中混有的Fe3+ | |
| D. | 泡沫灭火器中常使用的原料是碳酸钠和硫酸铝 |
| A. | 该溶液中,K+、Mg2+、Cl2、SO42-可以大量共存 | |
| B. | 已知电离平衡常数K(H2SO3)>K(H2CO3)>K(HSO3-),则该溶液中NH4+、HCO3-、Na+、Cl-不可以大量共存 | |
| C. | 和足量Ca(OH)2溶液反应的离子方程式:Ca2++OH-+HSO3-=CaSO3↓+H2O | |
| D. | 与稀HNO3反应的离子方程式:HSO3-+H+=SO2↑+H2O |
| A. | 离子半径:S2->Cl->O2- | B. | 还原性:Na>Mg>Al | ||
| C. | 沸点:HF>HCl>HBr | D. | 酸性:HClO4>H2SO4>H3PO4 |
| A. | 所有元素均为主族元素 | |
| B. | 金属元素的有7种 | |
| C. | 13号元素的最高价氧化物既能溶于强酸又能溶于强碱 | |
| D. | 8号元素的氢化物中所有原子都满足最外层8电子结构 |
| A. | CuSO4 | B. | HC1 | C. | NaCl | D. | NaOH |
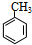
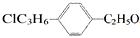 表示的有机物中,能发生消去反应的共有( )
表示的有机物中,能发生消去反应的共有( )| A. | 25种 | B. | 20种 | C. | 16种 | D. | 14种 |
| A. | 干电池中锌作负极,石墨棒作正极 | |
| B. | 负极发生还原反应:Zn-2e-═Zn2+ | |
| C. | MnO2的作用是把正极附近生成的氢气氧化成水,避免氢气泡出现 | |
| D. | 干电池工作时,由化学能转变为电能 |