9.已知:CH4(g)+2O2(g)═CO2(g)+2H2O(1)△H1=-Q1 KJ/mol
2H2(g)+O2(g)═2H2O(g)△H2=-Q2 KJ/mol
2H2(g)+O2(g)═2H2O(1)△H3=-Q3KJ/mol
常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则下列说法正确的是( )
2H2(g)+O2(g)═2H2O(g)△H2=-Q2 KJ/mol
2H2(g)+O2(g)═2H2O(1)△H3=-Q3KJ/mol
常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则下列说法正确的是( )
| A. | 放出的热量为(0.4Q1+0.1Q3)KJ | B. | 放出的热量为(0.4Q1+0.05Q2)KJ | ||
| C. | 放出的热量为(0.4Q1+0.05Q3)KJ | D. | △H2<△H3 |
8.锶(Sr)为第五周期ⅡA族元素.高纯六水氯化锶晶体(SrCl2•6H2O)具有很高的经济价值,61℃时晶体开始失去结晶水,100℃时失去全部结晶水.用工业碳酸锶粉末(含少量Ba、Fe的化合物)制备高纯六水氯化锶的过程如图.
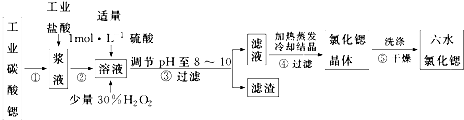
请回答:(1)步骤③中调节溶液pH至8~10,宜选用的试剂为BD.
A.稀硫酸 B.氢氧化锶粉末 C.氢氧化钠 D.氧化锶粉末
所得滤渣的主要成分是BaSO4、Fe(OH)3(填化学式).
(2)若滤液中Ba2+ 浓度为1×10-5mol•L-1,依据下表数据可以推算滤液中Sr2+物质的量浓度为不大于0.03mol/L.

请回答:(1)步骤③中调节溶液pH至8~10,宜选用的试剂为BD.
A.稀硫酸 B.氢氧化锶粉末 C.氢氧化钠 D.氧化锶粉末
所得滤渣的主要成分是BaSO4、Fe(OH)3(填化学式).
(2)若滤液中Ba2+ 浓度为1×10-5mol•L-1,依据下表数据可以推算滤液中Sr2+物质的量浓度为不大于0.03mol/L.
| SrSO4 | BaSO4 | Sr(OH)2 | Fe(OH)3 | Fe(OH)2 | |
| Ksp | 3.3×10-7 | 1.1×10-10 | 3.2×10-4 | 2.6×10-39 | 4.87×10-17 |
7.下列的图示与对应的叙述相符的是( )
| A. |  表示 KNO3 的溶解度曲线,图中 a 点表示的溶液通过升温可以得到 b 点 | |
| B. |  表示某一放热反应,若使用催化剂 E1、E2、△H 都会发生改变 | |
| C. |  表示向 Na2CO3 和 NaHCO3 的混合溶液中滴加稀盐酸时,产生 CO2 的情况 | |
| D. |  表示向 100mL0.1mol/L 的 AlCl3 和 0.1mol/L 的 NH4Cl 混合溶液中滴加 1mol/L 的 NaOH 溶液时 n(Al3+) 和 n(AlO2-)的变化情况 |
3.铜有两种常见的氧化物:CuO和Cu2O.某学习小组取0.98g Cu(OH)2固体加热,有铜的氧化物生成,其质量随温度变化如图1所示;另外,某同学绘制了三条表示金属氧化物与其所含金属元素的质量的关系曲线,如图2所示;则下列分析正确的是( )
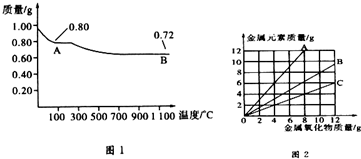

| A. | 图1中产物A、B的化学式分别为Cu2O和CuO | |
| B. | 图1整个过程中共生成0.26g水 | |
| C. | 图2三条曲线中,表示CuO和其中所含Cu元素质量关系的曲线是C | |
| D. | 图1中,A到B过程中有0.01 mol电子发生了转移 |
1.某溶液既能溶解Al(OH)3,又能溶解H2SiO3,在该溶液中可以大量共存的离子组是( )
0 167137 167145 167151 167155 167161 167163 167167 167173 167175 167181 167187 167191 167193 167197 167203 167205 167211 167215 167217 167221 167223 167227 167229 167231 167232 167233 167235 167236 167237 167239 167241 167245 167247 167251 167253 167257 167263 167265 167271 167275 167277 167281 167287 167293 167295 167301 167305 167307 167313 167317 167323 167331 203614
| A. | K+、Na+、HCO3-、NO3- | B. | Ag+、K+、NO3-、Na+ | ||
| C. | H+、Mg2+、SO42-、NO3- | D. | Na+、SO42-、Cl-、ClO- |