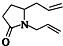
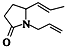
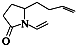
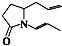
题目内容
4.某温度下,取一定质量的硫酸铜溶液,用石墨做电极进行电解,当阳极产生标况下气体1.12L时,CuSO4恰好被完全电解,得到密度为1.2g•cm-3的溶液200mL.求:(1)电解后所得溶液的[H+]为1mol/L.
(2)电解前所取CuSO4溶液的质量为248.0g.
(3)若要使电解后所得溶液恢复至电解前的原状态,需要加入何种物质(只要求写出一种),其化学式为CuO,加入物质的质量为8.0g.
分析 用石墨电极电解CuSO4溶液,阳极反应为:4OH--4e-═2H2O+O2↑,阴极电极反应为:Cu2++2e-=Cu,总反应离子方程式为:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+4H++O2↑,当阳极产生标准状况下气体1.12L时,生成氧气的物质的量为:$\frac{1.12L}{22.4L/mol}$=0.05mol,电子转移0.05mol×4=0.2mol,同时阴极析出铜6.4g,电解过程中依据出什么加什么原则,据此分析计算.
解答 解:(1)在25℃时,用石墨电极电解CuSO4溶液,阳极反应为:4OH--4e-═2H2O+O2↑,阴极电极反应为:Cu2++2e-=Cu;当阳极产生标准状况下气体1.12L时,生成氧气的物质的量为:$\frac{1.12L}{22.4L/mol}$=0.05mol,电子转移0.05mol×4=0.2mol,同时阴极析出铜6.4g,电解过程中,阳极反应为:4OH--4e-═2H2O+O2↑,阴极电极反应为:Cu2++2e-=Cu,总反应离子方程式为:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+4H++O2↑,
2mol 4mol 22.4L
n(Cu2+) n(H+) 1.12L
n=$\frac{4mol×1.12L}{22.4L/mol}$=0.2mol,c(H+)=$\frac{0.2mol}{0.2L}$=1mol/L,故答案为:1mol/L;
(2)析出氧气的质量为:0.05mol×32g/mol=1.6g,析出铜的质量为6.4g,故原溶液质量为:1.6g+6.4g+1.2g•cm-3×200mL=248.0g,
故答案为:248.0;
(3)电解过程中依据出什么加什么原则,电解过程中析出铜和氧气,所以要使电解后溶液恢复到电解前的状态加入氧化铜可以恢复溶液浓度,析出氧气的质量为:0.05mol×32g/mol=1.6g,析出铜的质量为6.4g,故加入氧化铜的质量为:1.6g+6.4g=8.0g,故答案为:CuO;8.0.
点评 本题考查了电解原理的应用,电极反应的书写方法,电子守恒的计算应用,中等难度,清楚电极反应是解题的关键.

 寒假学与练系列答案
寒假学与练系列答案| A. | ④③②① | B. | ②④③① | C. | ①②③④ | D. | ①②④③ |
| A. | 6:11 | B. | 2:3 | C. | 2:5 | D. | 6:5 |
| A. | 标准状况下,2.24L苯中约含有3.612×1023个碳原子 | |
| B. | 常温常压下,氧气和臭氧的混合物16g中约含有6.02×1023个氧原子 | |
| C. | 1L 1mol/L醋酸溶液中离子总数为1.204×l024 | |
| D. | 0.5mol CH4中约含有3.01×1023个电子 |
2H2(g)+O2(g)═2H2O(g)△H2=-Q2 KJ/mol
2H2(g)+O2(g)═2H2O(1)△H3=-Q3KJ/mol
常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则下列说法正确的是( )
| A. | 放出的热量为(0.4Q1+0.1Q3)KJ | B. | 放出的热量为(0.4Q1+0.05Q2)KJ | ||
| C. | 放出的热量为(0.4Q1+0.05Q3)KJ | D. | △H2<△H3 |
①NaOH ②AgNO3 ③Na2CO3 ④NaBr ⑤KI.
| A. | 只有①② | B. | 只有①④⑤ | C. | 只有②④⑤ | D. | ①②③④⑤ |
| A. | BeCl2为共价化合物 | |
| B. | At2为无色固体,HAt不稳定,AgAt感光性强,但不溶于水也不溶于稀酸 | |
| C. | 硫酸钡是难溶于水的白色固体 | |
| D. | 硒化氢是无色、有毒、比H2S稳定的气体 |
 固定和利用CO2,能有效地利用资源,并减少空气中的温室气体.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1
固定和利用CO2,能有效地利用资源,并减少空气中的温室气体.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1
 的是( )
的是( )