题目内容
3.铜有两种常见的氧化物:CuO和Cu2O.某学习小组取0.98g Cu(OH)2固体加热,有铜的氧化物生成,其质量随温度变化如图1所示;另外,某同学绘制了三条表示金属氧化物与其所含金属元素的质量的关系曲线,如图2所示;则下列分析正确的是( )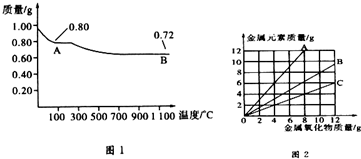
| A. | 图1中产物A、B的化学式分别为Cu2O和CuO | |
| B. | 图1整个过程中共生成0.26g水 | |
| C. | 图2三条曲线中,表示CuO和其中所含Cu元素质量关系的曲线是C | |
| D. | 图1中,A到B过程中有0.01 mol电子发生了转移 |
分析 0.98 g Cu(OH)2的物质的量为$\frac{0.98g}{98g/mol}$=0.01 mol,若完全分解得到CuO,由Cu元素守恒,n(CuO)=0.01 mol,m(CuO)=0.01mol×80g/mol=0.8g,若完全分解得到Cu2O,由Cu元素守恒,n(Cu2O)=$\frac{0.01mol}{2}$=0.005mol,m(Cu2O)=0.005mol×144g/mol=0.72g,故A为CuO、B为Cu2O,
A.由上述分析可知,A为CuO、B为Cu2O;
B.根据H元素守恒计算水的物质的量,再根据m=nM计算生成水的质量;
C.根据CuO的化学式计算CuO中所含Cu元素的质量与CuO的质量之比,结合图象判断;
D.由A点到B点发生反应:4CuO$\frac{\underline{\;高温\;}}{\;}$2Cu2O+O2↑,CuO完全分解为Cu2O,结合Cu元素化合价变化计算转移电子.
解答 解:0.98 g Cu(OH)2的物质的量为$\frac{0.98g}{98g/mol}$=0.01 mol,若完全分解得到CuO,由Cu元素守恒,n(CuO)=0.01 mol,m(CuO)=0.01mol×80g/mol=0.8g,若完全分解得到Cu2O,由Cu元素守恒,n(Cu2O)=$\frac{0.01mol}{2}$=0.005mol,m(Cu2O)=0.005mol×144g/mol=0.72g,故A为CuO、B为Cu2O,
A.由上述分析可知,A为CuO、B为Cu2O,故A错误;
B.根据H元素守恒,生成水的物质的量为:$\frac{0.01mol×2}{2}$=0.01mol,故生成水的质量为:0.01mol×18g/mol=0.18g,故B错误;
C.根据CuO的化学式可知CuO中所含Cu元素的质量与CuO的质量之比=64:80=4:5,即曲线斜率为0.8,曲线A的斜率大于1,曲线C的斜率为0.5,曲线B的斜率为0.8,故曲线B表示表示CuO和其中所含Cu元素质量关系,故C错误;
D.由A点到B点发生反应:4CuO$\frac{\underline{\;高温\;}}{\;}$2Cu2O+O2↑,CuO完全分解为Cu2O,Cu元素化合价由+2价降低为+1价,故转移电子为0.01mol×(2-1)=0.01mol,故D正确;
故选D.
点评 本题考查混合物反应的计算,为高频考点,题目难度中等,把握极限法判断A、B对应的物质是解题关键,试题侧重分析、计算能力的综合考查.

| A. | 标准状况下,22.4L就是气体摩尔体积 | |
| B. | 标准状况下,22.4L任何物质都含有大约6.02×1023个分子 | |
| C. | 非标准状况下,1mol任何气体的体积不可能为22.4L | |
| D. | 1mol氢气和氧气的混合气体在标准状况下的体积约为22.4L |
| A. | 水 | B. | NaOH溶液 | C. | 饱和食盐水 | D. | 石灰水 |
| 实验Ⅰ | 实验Ⅱ | 实验Ⅲ | |
| 反应温度/℃ | 800 | 800 | 850 |
| c(A)起始/mol•L-1 | 1 | 2 | 1 |
| c(A)平衡/mol•L-1 | 0.5 | 1 | 0.85 |
| 放出的热量/kJ | a | b | c |
| A. | 实验Ⅲ的化学平衡常数K<1 | |
| B. | 实验放出的热量关系为b=2a | |
| C. | 实验Ⅲ在30 min达到平衡,30 min内A的速率:v(A)=0.002 5 mol•L-1•min-1 | |
| D. | 当容器内气体密度不随时间而变化时上述反应达到平衡 |
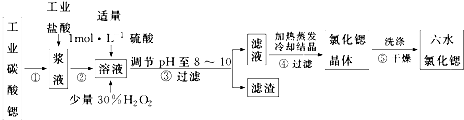
请回答:(1)步骤③中调节溶液pH至8~10,宜选用的试剂为BD.
A.稀硫酸 B.氢氧化锶粉末 C.氢氧化钠 D.氧化锶粉末
所得滤渣的主要成分是BaSO4、Fe(OH)3(填化学式).
(2)若滤液中Ba2+ 浓度为1×10-5mol•L-1,依据下表数据可以推算滤液中Sr2+物质的量浓度为不大于0.03mol/L.
| SrSO4 | BaSO4 | Sr(OH)2 | Fe(OH)3 | Fe(OH)2 | |
| Ksp | 3.3×10-7 | 1.1×10-10 | 3.2×10-4 | 2.6×10-39 | 4.87×10-17 |
| A. | 2s22p2和2s22p4 | B. | 3s23p4和2s22p4 | C. | 3s2和2s22p5 | D. | 3s1和3s23p4 |
| A. | C10H16 | B. | C11H14 | C. | C12H18 | D. | C13H20 |