7.根据电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如表所示:
(1)已知25℃时,①HF(aq)+OH-(aq)═F-(aq)+H2 O(l)△H=-67.7kJ•
mol-1 ②H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
氢氟酸的电离方程式及热效应可表示为HF(aq)?H+(aq)+F-(aq)△H=-10.4KJ•mol-1.
(2)将浓度为0.1mol•L-1的HF溶液加水稀释一倍(假设温度不变),下列各项中的值将增大的是CD.
A.c(H+) B.c(H+)•c(OH-) C.$\frac{c(H+)}{c(HF)}$ D.$\frac{c(OH-)}{c(H+)}$
(3)下列方法中,可以使0.10mol•L-1 HF溶液中HF电离程度增大的是d.(请填字母且注意区分大小写,大小写填错不得分)
a.升高温度
b.向溶液中滴入2滴浓盐酸
c.加入少量NaF固体
d.加水稀释.
| 物质 | HF | H2CO3 | HClO |
| 电离平衡常数(Ka) | 7.2×10-4 | Kal=4.4×10-7 Ka2=4.7×10-11 | 3.0×10-8 |
mol-1 ②H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
氢氟酸的电离方程式及热效应可表示为HF(aq)?H+(aq)+F-(aq)△H=-10.4KJ•mol-1.
(2)将浓度为0.1mol•L-1的HF溶液加水稀释一倍(假设温度不变),下列各项中的值将增大的是CD.
A.c(H+) B.c(H+)•c(OH-) C.$\frac{c(H+)}{c(HF)}$ D.$\frac{c(OH-)}{c(H+)}$
(3)下列方法中,可以使0.10mol•L-1 HF溶液中HF电离程度增大的是d.(请填字母且注意区分大小写,大小写填错不得分)
a.升高温度
b.向溶液中滴入2滴浓盐酸
c.加入少量NaF固体
d.加水稀释.
5.已知水的电离平衡曲线如图,下列说法正确的是( )
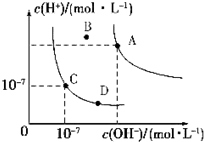

| A. | 水的离子积常数关系为:KW(B)>KW(A)>KW(C)>KW(D) | |
| B. | B点对应的温度下,pH=4的硫酸与pH=10的氢氧化钠溶液等体积混合,溶液的pH=7 | |
| C. | 向水中加入醋酸钠固体,可从C点到D点 | |
| D. | 升高温度可实现由C点到D点 |
4.下列操作能促进水的电离,且使溶液的pH>7的是( )
| A. | 将纯水加热到90℃ | B. | 向水中加少量Na2CO3溶液 | ||
| C. | 向水中加少量NaOH溶液 | D. | 向水中加少量FeCl3溶液 |
3.下列说法正确的是( )
| A. | 液面在“0”刻度时,50 mL碱式滴定管和25 mL碱式滴定管所盛液体的体积,其比值一定为2:1 | |
| B. | 将NaOH溶液和氨水溶液各稀释一倍,两者的OH-浓度均减少到原来的二分之一 | |
| C. | 如果盐酸的浓度是醋酸浓度的二倍,则盐酸的H+浓度也是醋酸的二倍 | |
| D. | 制取TiO2可用TiCl4加大量水,同时加热:TiCl4+(x+2)H2O(过量)?TiO2•xH2O↓+4HCl,所得的TiO2•H2O经焙烧得TiO2 |
2.下列推论正确的是( )
| A. | S(g)+O2(g)=SO2(g)△H1,S(s)+O2(g)=SO2(g)△H2,则△H1>△H2 | |
| B. | NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.4 kJ/mol,则含20 g NaOH的稀溶液与稀盐酸完反应,放出的热量为28.7 kJ | |
| C. | C(石墨,s)=C(金刚石,s)△H=+1.9 kJ/mol,则由石墨制取金刚石的反应是吸热反应,金刚石比石墨稳定 | |
| D. | 2C(s)+O2(g)=2CO(g)△H=-221 kJ/mol,则碳的燃烧热等于 110.5 kJ/mol |
1.298.15K时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH=1的溶液中:Na+、K+、MnO4-、CO32- | |
| B. | c(H+)=1×10-13mol/L的溶液中:Mg2+、Cu2+、SO42-、NO3- | |
| C. | 0.1mol/LNH4HCO3溶液中:K+、Na+、NO3-、Cl- | |
| D. | 0.1mol/LFeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |
20.运用相关化学知识进行判断,下列结论错误的是( )
0 167094 167102 167108 167112 167118 167120 167124 167130 167132 167138 167144 167148 167150 167154 167160 167162 167168 167172 167174 167178 167180 167184 167186 167188 167189 167190 167192 167193 167194 167196 167198 167202 167204 167208 167210 167214 167220 167222 167228 167232 167234 167238 167244 167250 167252 167258 167262 167264 167270 167274 167280 167288 203614
| A. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 | |
| B. | NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中 | |
| C. | 可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 | |
| D. | 某吸热反应能自发进行,因此该反应是熵增反应 |

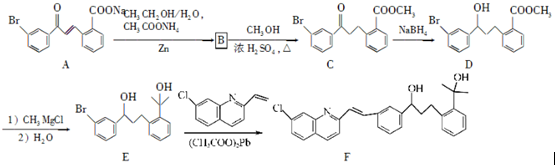 请回答下列问题:
请回答下列问题: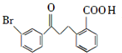 .
.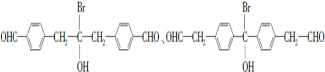 .
. 为原料制备
为原料制备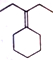 的合成路线流程图(乙醚溶剂及无机试剂任用)
的合成路线流程图(乙醚溶剂及无机试剂任用)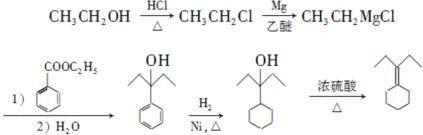 ;
;