11.下列有关化学用语或叙述正确的是( )
| A. | C50、N70、C120、C540等互称为同素异形体 | |
| B. | CH3CH2CH2CH2OH的名称是:丁醇 | |
| C. | 2-戊烯的结构简式:CH3CH2CH=CHCH3 | |
| D. | 质子数为94、中子数为144的钚(Pu)原子:${\;}_{92}^{144}$Pu. |
10.NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1.0mol/L的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 12g金刚石中含有碳酸键的个数为2NA | |
| C. | 25℃时1.0LpH=13的NaOH溶液中含有H+的数目为0.1NA | |
| D. | 1mol的甲基与1mol的铵银离子所含电子数均为10NA. |
9.下列说法中,正确的是( )
| A. | 光导纤维、聚酯纤维、棉花都属于高分子化合物 | |
| B. | 在大米酿酒的过程中,淀粉最后变成了单糖 | |
| C. | 明矾和漂白粉处理自来水,二者的作用原理相同 | |
| D. | 合成顺丁橡胶( )的单体是CH2=CH-CH=CH2. )的单体是CH2=CH-CH=CH2. |
6.室温下,下列溶液中粒子浓度关系正确的是( )
| A. | KAl(SO4)2溶液:c(SO42-)>(K+)=c(Al3+ )>c(H+)>c(OH-) | |
| B. | NaHCO3溶液:c(Na+)+c(H+)=c(CO32-)+c(OH-)+c(HCO3-) | |
| C. | Na2S溶液:c(OH-)-(H+)=c(HS-)+c(H2S) | |
| D. | CH3COONa与 HCl混合后呈中性的溶液:c(Na+)>c(Cl-)=c(CH3COOH) |
5.CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值产品是目前的研究目标.
(1)250℃时,以镍合金为催化剂,向4L容器中通入6molCO2、6molCH4,发生反应:CO2(g)+CH4(g)?2CO(g)+2H2(g).平衡体系中各组分物质的量如表:
①此温度下该反应的平衡常数K=64.
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H=+2.8kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ.mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g)的△H=+247.3 kJ•mol-1.
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂.可以将CO2和CH4直接转化为成乙酸.
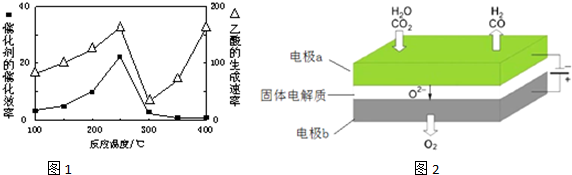
①在不同温度下催化剂的催化效果与乙酸的生成速率如图1所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是温度超过250℃时,催化剂的催化效率降低.
②为了提高该反应中CH4的转化率,可以采取的措施是缩小体积增大压强或增大CO2的浓度.
(3)①Li2O、Na2O、MgO均能吸收CO2.如果寻找吸收CO2的其他物质,下列建议合理的是ab.
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4用于吸收、释放CO2.原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3和另一种盐;平衡后加热至700℃,反应逆向进行放出CO2,Li4SiO4再生,写出CO2和Li4SiO4反应的化学方程式CO2+Li4SiO4$\frac{\underline{\;500℃\;}}{\;}$Li2CO3+Li2SiO3.
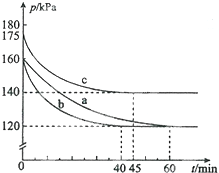
(4)反应A:CO2+H2O$\frac{\underline{\;电解\;}}{高温}$CO2+H2+O2利用反应A可将释放的CO2转化为具有工业利用价值的产品.高温电解技术能高效实现反应A,工作原理示意图如图2.CO2在电极a放电的反应式是CO2+2e-═CO+O2-.
0 167065 167073 167079 167083 167089 167091 167095 167101 167103 167109 167115 167119 167121 167125 167131 167133 167139 167143 167145 167149 167151 167155 167157 167159 167160 167161 167163 167164 167165 167167 167169 167173 167175 167179 167181 167185 167191 167193 167199 167203 167205 167209 167215 167221 167223 167229 167233 167235 167241 167245 167251 167259 203614
(1)250℃时,以镍合金为催化剂,向4L容器中通入6molCO2、6molCH4,发生反应:CO2(g)+CH4(g)?2CO(g)+2H2(g).平衡体系中各组分物质的量如表:
| 物质 | CH4 | CO2 | CO | H2 |
| 物质的量mol | 2 | 2 | 8 | 8 |
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H=+2.8kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ.mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g)的△H=+247.3 kJ•mol-1.
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂.可以将CO2和CH4直接转化为成乙酸.
①在不同温度下催化剂的催化效果与乙酸的生成速率如图1所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是温度超过250℃时,催化剂的催化效率降低.
②为了提高该反应中CH4的转化率,可以采取的措施是缩小体积增大压强或增大CO2的浓度.
(3)①Li2O、Na2O、MgO均能吸收CO2.如果寻找吸收CO2的其他物质,下列建议合理的是ab.
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4用于吸收、释放CO2.原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3和另一种盐;平衡后加热至700℃,反应逆向进行放出CO2,Li4SiO4再生,写出CO2和Li4SiO4反应的化学方程式CO2+Li4SiO4$\frac{\underline{\;500℃\;}}{\;}$Li2CO3+Li2SiO3.

(4)反应A:CO2+H2O$\frac{\underline{\;电解\;}}{高温}$CO2+H2+O2利用反应A可将释放的CO2转化为具有工业利用价值的产品.高温电解技术能高效实现反应A,工作原理示意图如图2.CO2在电极a放电的反应式是CO2+2e-═CO+O2-.
 化合物AX3和单质X2在一定条件下反应可生成化合物AX5,该反应不能彻底.回答下列问题:
化合物AX3和单质X2在一定条件下反应可生成化合物AX5,该反应不能彻底.回答下列问题: 甲醇脱氧制取甲醛的原理为CH3OH(g)?HCHO(g)+H2(g),某科研小组在1L恒溶密闭容器中充入1molCH3OH,对该反应进行了一系列的研究,得到甲醇的平衡转化率随温度的变化曲线如图所示.
甲醇脱氧制取甲醛的原理为CH3OH(g)?HCHO(g)+H2(g),某科研小组在1L恒溶密闭容器中充入1molCH3OH,对该反应进行了一系列的研究,得到甲醇的平衡转化率随温度的变化曲线如图所示.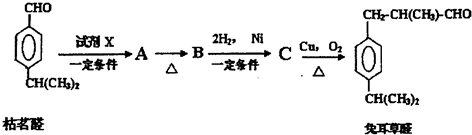
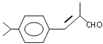 ;检验B中的官能团时,需先加入的试剂是新制氢氧化铜悬浊液;酸化后,再加入的试剂是溴水或高锰酸钾溶液.
;检验B中的官能团时,需先加入的试剂是新制氢氧化铜悬浊液;酸化后,再加入的试剂是溴水或高锰酸钾溶液. .
.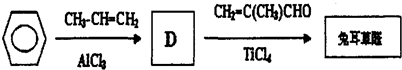
 .D→兔耳草醛的反应类型是加成反应.
.D→兔耳草醛的反应类型是加成反应. 、
、 .
.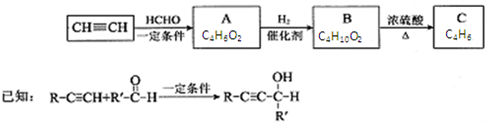
 ,其反应类型消去反应.
,其反应类型消去反应.