题目内容
2.以乙炔或苯为原料可合成有机酸H2MA,并进一步合成高分子化合物PMLA.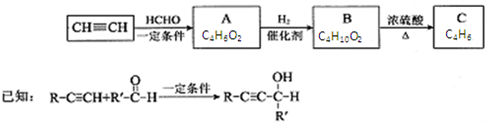
I.用乙炔等合成烃C.
(1)A分子中的官能团名称是羟基、碳碳三键
(2)A的一种同分异构体属于乙酸酯,其结构简式是CH3COOCH=CH2
(3)B转化为C的化学方程式是
 ,其反应类型消去反应.
,其反应类型消去反应.
分析 由A的分子式结合信息,可知1分子甲醛与2分子乙炔发生加成反应生成A,则A的结构简式为HOCH2C≡CCH2OH,A与氢气发生加成反应生成B为HOCH2CH2CH2CH2OH,B再浓硫酸作用下发生消去反应生成CH2=CHCH=CH2,据此答题.
解答 解:由A的分子式结合信息,可知1分子甲醛与2分子乙炔发生加成反应生成A,则A的结构简式为HOCH2C≡CCH2OH,A与氢气发生加成反应生成B为HOCH2CH2CH2CH2OH,B再浓硫酸作用下发生消去反应生成CH2=CHCH=CH2,
(1)A的结构简式为HOCH2C≡CCH2OH,含有官能团的名称是:羟基、碳碳三键,
故答案为:羟基;碳碳三键;
(2)A的一种同分异构体属于乙酸酯,根据酯的构成,醇的部分应是乙烯醇,所以其结构简式为:CH3COOCH=CH2,
故答案为:CH3COOCH=CH2;
(3)B应为1,4-丁二醇,在浓硫酸催化下发生消去反应,化学方程式为 ,
,
故答案为: ;消去反应.
;消去反应.
点评 本题考查有机物的推断与合成,注意根据反应信息与A的分子式推断其结构,再利用顺推法推断B、C,侧重考查学生分析推理能力,难度中等.

练习册系列答案
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案
相关题目
6.下列分子中,所有原子都满足最外层8电子结构且为非极性分子的是( )
| A. | PCl5 | B. | SiH4 | C. | NF3 | D. | CO2 |
7.常温下用aL pH=3的醋酸与bLpH=11的氢氧化钠溶液混合得到溶液,下列叙述正确的是( )
| A. | 若两种恰好中和,则一定是a=b | B. | 若混合液显碱性,则一定是b≥a | ||
| C. | 若混合液显中性,则可能有a>b | D. | 若混合液显酸性,则可能有a≤b |
10.能源的相互转化和利用是科学家研究的重要课题.
(1)将水蒸气通过红热的炭即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1.
①该反应自发进行的外界条件是较高温度.
②在一个恒容的密闭容器中,一定温度下发生上述反应,下列能判断该反应达到化学平衡状态的是BC (填相应的编号).
A.CO和H2的体积分数相同
B.1mol H-H键断裂的同时断裂2mol H-O键
C.容器中的压强不变
D.消耗H2O的速率等于生成H2的速率
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,在催化剂存在下进行反应:
CO(g)+H2O(g)?H2(g)+CO2(g),得到如表中二组数据:
①该反应的△H<0(填“>”、“<”或“=”).
②计算实验2条件下平衡常数的值K=0.17.
(3)pKa表示的是弱电解质电离平衡常数的负对数,即pKa=-lgKa,有关数据如图: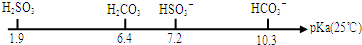
①0.01mol•L-1NaHSO3溶液的pH=bl,0.01mol•L-1NaHCO3溶液的pH=b2,则b1<b2(填“>”、“<”或“=”).
②向10mL 0.01mol•L-1的H2SO3溶液中,滴加0.0l mol•L-1KOH溶液10mL,溶液中存在c(H+)>c(OH-),则以下四种微粒K+、H2SO3、HSO3-、SO32-,其浓度由大到小的顺序为c(K+)>c(HSO3-)>c(SO32-)>c(H2SO3).
(1)将水蒸气通过红热的炭即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1.
①该反应自发进行的外界条件是较高温度.
②在一个恒容的密闭容器中,一定温度下发生上述反应,下列能判断该反应达到化学平衡状态的是BC (填相应的编号).
A.CO和H2的体积分数相同
B.1mol H-H键断裂的同时断裂2mol H-O键
C.容器中的压强不变
D.消耗H2O的速率等于生成H2的速率
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,在催化剂存在下进行反应:
CO(g)+H2O(g)?H2(g)+CO2(g),得到如表中二组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
| CO | H2O | H2 | CO | ||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 |
②计算实验2条件下平衡常数的值K=0.17.
(3)pKa表示的是弱电解质电离平衡常数的负对数,即pKa=-lgKa,有关数据如图:
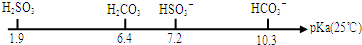
①0.01mol•L-1NaHSO3溶液的pH=bl,0.01mol•L-1NaHCO3溶液的pH=b2,则b1<b2(填“>”、“<”或“=”).
②向10mL 0.01mol•L-1的H2SO3溶液中,滴加0.0l mol•L-1KOH溶液10mL,溶液中存在c(H+)>c(OH-),则以下四种微粒K+、H2SO3、HSO3-、SO32-,其浓度由大到小的顺序为c(K+)>c(HSO3-)>c(SO32-)>c(H2SO3).
17. 控制适合的条件,将反应AsO43-+2I-+2H+? AsO33-+I2+H2O 设计成如图所示的原电池.下列判断正确的是( )
控制适合的条件,将反应AsO43-+2I-+2H+? AsO33-+I2+H2O 设计成如图所示的原电池.下列判断正确的是( )
 控制适合的条件,将反应AsO43-+2I-+2H+? AsO33-+I2+H2O 设计成如图所示的原电池.下列判断正确的是( )
控制适合的条件,将反应AsO43-+2I-+2H+? AsO33-+I2+H2O 设计成如图所示的原电池.下列判断正确的是( )| A. | 反应开始时,B池中石墨电极上发生氧化反应 | |
| B. | 反应开始时,A池中石墨电极上I-被还原 | |
| C. | 反应开始时,盐桥中K+由左向右迁移 | |
| D. | 电流计读数为零后,在B池中溶入Na3AsO3固体,B池中的石墨电极为正极 |
11.下列说法不正确的是( )
| A. | 生物质能来源于植物及其加工产品所贮存的能量,绿色植物通过光合作用将化学能转化为生物质能 | |
| B. | 用氨水法处理燃煤烟气中的二氧化硫,即可消除其污染,又可得到副产品硫酸铵 | |
| C. | 某小组研究人员成功制备出了四氧化铱正离子(IrO4+),其球棍模型为 ,由此可判断其中铱元素显+9价 ,由此可判断其中铱元素显+9价 | |
| D. | 门捷列夫根据元素性质随元素的相对原子质量递增而显现元素周期性变化的规律排出了第一张元素周期表 |
 有A、B、C、D、E五种短周期元素,A、C同周期,B、D同主族,E是五种元素中原子半径最小的元素.A是构成矿物和岩石的主要成分的元素,C、D可生成离子化合物C3D2.A的单质与E的单质在常温下就可发生反应,生成化合物F.据此回答下列问题:
有A、B、C、D、E五种短周期元素,A、C同周期,B、D同主族,E是五种元素中原子半径最小的元素.A是构成矿物和岩石的主要成分的元素,C、D可生成离子化合物C3D2.A的单质与E的单质在常温下就可发生反应,生成化合物F.据此回答下列问题: ;A单质及其最高价氧化物均属于原子晶体(填晶体类型)
;A单质及其最高价氧化物均属于原子晶体(填晶体类型)