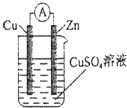
题目内容
11.下列有关化学用语或叙述正确的是( )| A. | C50、N70、C120、C540等互称为同素异形体 | |
| B. | CH3CH2CH2CH2OH的名称是:丁醇 | |
| C. | 2-戊烯的结构简式:CH3CH2CH=CHCH3 | |
| D. | 质子数为94、中子数为144的钚(Pu)原子:${\;}_{92}^{144}$Pu. |
分析 A.由一种元素组成的不同单质互称为同素异形体,互为同素异形体的物质要符合以下两个条件:同种元素形成,不同单质;
B.多碳醇需标明官能团所在的位置;
C.2-戊烯即碳碳双键在2号碳和3号碳之间的戊烯;
D.元素符号的左上角表示的是质量数,Pu的质量数为238,左下角表示的是质子数为94;
解答 解:A.同素异形体是同种元素形成的不同单质,C50、C120、C540互称为同素异形体,但N70不是,故A错误;
B.CH3CH2CH2CH2OH的名称是:1-丁醇,故B错误;
C.主链为五个碳的烯,2-戊烯即碳碳双键在2号碳和3号碳之间的戊烯,2-戊烯的结构简式:CH3CH2CH=CHCH3,故C正确;
D.质子数为94、中子数为144的钚(Pu)原子,其质量数=质子数+中子数=94+144=238,质子数为94,左上角为238,左下角为94,故D错误;
故选C.
点评 本题考查了同素异形体、醇烯的命名等化学用语,题目难度不大,注意掌握常见的化学用语的表示方法,明确元素符号的左上角左下角数字的含义为高频考点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.下列说法正确的是( )
| A. | 按系统命名法,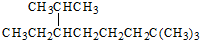 的名称为2,2,7-三甲基-6-乙基辛烷 的名称为2,2,7-三甲基-6-乙基辛烷 | |
| B. | 青蒿素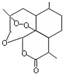 是抗恶性疟疾特效药,其分子式为C15H20O5 是抗恶性疟疾特效药,其分子式为C15H20O5 | |
| C. | 1mol达菲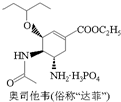 最多能与4molNaOH反应 最多能与4molNaOH反应 | |
| D. | CH3CH=CH-CH=CH2与溴的四氯化碳溶液发生加成反应最多可生成3种产物 |
2.芳香族羧酸通常用芳香烃的氧化来制备.芳香烃的苯环比较稳定,难于氧化,而环上的支链不论长短,在强烈氧化时,最终都氧化成羧基.某同学用甲苯的氧化反应制备苯甲酸.
反应原理:
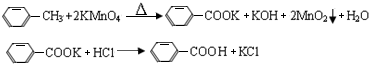
反应试剂、产物的物理常数:
主要实验装置和流程如下:
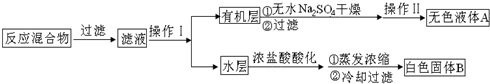
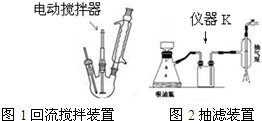
实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在100℃时,反应一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.
(1)图2仪器K的名称为安全瓶.无色液体A的结构简式为 .操作Ⅱ为蒸馏.
.操作Ⅱ为蒸馏.
(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是除去未反应的高锰酸钾氧化剂,否则用盐酸酸化时会发生盐酸被高锰酸钾所氧化,产生氯气.
(3)下列关于仪器的组装或者使用正确的是ABD.
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌棒下端不能与三颈烧瓶底、温度计等接触
C.抽滤结束后,为防止倒吸,应先关闭水龙头,再断开真空系统与过滤系统的连接
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入NaOH溶液,分液,水层再加入浓盐酸酸化,然后抽滤,干燥即可得到苯甲酸.
(5)纯度测定:称取1.220g产品,配成100mL溶液,取其中25.00mL溶液,进行滴定,消耗KOH物质的量为2.4×10-3mol.产品中苯甲酸质量分数为96%.
反应原理:

反应试剂、产物的物理常数:
| 名称 | 相对分子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | ∞ | ∞ |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |


实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在100℃时,反应一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.
(1)图2仪器K的名称为安全瓶.无色液体A的结构简式为
 .操作Ⅱ为蒸馏.
.操作Ⅱ为蒸馏.(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是除去未反应的高锰酸钾氧化剂,否则用盐酸酸化时会发生盐酸被高锰酸钾所氧化,产生氯气.
(3)下列关于仪器的组装或者使用正确的是ABD.
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌棒下端不能与三颈烧瓶底、温度计等接触
C.抽滤结束后,为防止倒吸,应先关闭水龙头,再断开真空系统与过滤系统的连接
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入NaOH溶液,分液,水层再加入浓盐酸酸化,然后抽滤,干燥即可得到苯甲酸.
(5)纯度测定:称取1.220g产品,配成100mL溶液,取其中25.00mL溶液,进行滴定,消耗KOH物质的量为2.4×10-3mol.产品中苯甲酸质量分数为96%.
6.室温下,下列溶液中粒子浓度关系正确的是( )
| A. | KAl(SO4)2溶液:c(SO42-)>(K+)=c(Al3+ )>c(H+)>c(OH-) | |
| B. | NaHCO3溶液:c(Na+)+c(H+)=c(CO32-)+c(OH-)+c(HCO3-) | |
| C. | Na2S溶液:c(OH-)-(H+)=c(HS-)+c(H2S) | |
| D. | CH3COONa与 HCl混合后呈中性的溶液:c(Na+)>c(Cl-)=c(CH3COOH) |
3.下列有关阳离子的说法中错误的是 ( )
①非金属原子不能形成阳离子;
②阳离子都是由一个金属原子失去电子而形成的;
③阳离子的价态不会大于其原子的最外层电子数;
④阳离子都是稳定结构,不会再失去电子;
⑤阳离子的电子排布一定与稀有气体元素原子相同.
①非金属原子不能形成阳离子;
②阳离子都是由一个金属原子失去电子而形成的;
③阳离子的价态不会大于其原子的最外层电子数;
④阳离子都是稳定结构,不会再失去电子;
⑤阳离子的电子排布一定与稀有气体元素原子相同.
| A. | ①④⑤ | B. | ②③④ | C. | ①②③ | D. | ①②③④⑤ |
20.下列说法不正确的是( )
| A. | iPhone5外壳易掉色原因是,铝壳表面氧化处理过程中作为阳极的金属铝纯度不够 | |
| B. | 道尔顿、汤姆生、卢瑟福、玻尔等科学家的研究不断更新人们对原子结构的认识 | |
| C. | H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快 | |
| D. | 古代的陶瓷、砖瓦,现代的普通玻璃、水泥都是硅酸盐产品 |

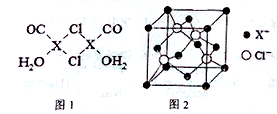 元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子,在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2XCl+2CO+2H2O═X2Cl2•2CO•2H2O.
元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子,在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2XCl+2CO+2H2O═X2Cl2•2CO•2H2O.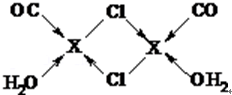 .
.