3.下列溶液中粒子的物质的量浓度关系一定正确的是( )
| A. | 常温下,pH=9的NaHA溶液:c(Na+)>c(HA-)>c(A2-)c(H2A) | |
| B. | Na2CO3溶液:c(H+)-c(OH-)=c(HCO3-)+2c(CO32-)-c(Na+) | |
| C. | 向NaOH溶液中滴入HCOOH溶液后溶液显碱性:c(HCOO-)>c(OH-)>c(H+) | |
| D. | 浓度均为0.1mol•L-1HF溶液与0.1mol•L-1KF溶液等体积混合:c(F-)+c(HF)=0.2mol•L-1 |
20.常温下,浓度均为0.1mol•L-1的6种溶液的pH如表:
请根据上述信息回答下列问题:
(1)上述c和d溶液所含溶质对应的酸其酸性强弱为HClO>HCN(用化学式表示);
(2)结合表中数据分析,常温下与溶质a对水的电离程度影响相同的是B;
A.pH=8.8的NaOH溶液
B.pH=5.2的NH4Cl溶液
C.pH=5.2的盐酸
D.0.2mol•L-1的NaCN溶液
(3)用离子方程式表示c溶液呈碱性的原因是ClO-+H2O?HClO+OH-.
(4)如果将b溶液加入到含相同物质的量的BaCl2和ZnCl2的混合稀溶液中,首先析出的沉淀是ZnCO3[已知K(BaCO3)=5.1×10-9,K(ZnCO3)=1.4×10-11].
(5)浓度为0.1mol•L-1的e中离子浓度由大到小的顺序为c(Na+)>c(C6H5O?)>c(OH-)>c(H+).
(6)100℃时纯水中c(H+)=10-6mol•L-1,在此温度下某浓度的d溶液的pH=n,则c(H+)+c(HCN)=10n-12mol•L-1 .
| 溶液 | a | b | c | d | e |
| 溶质 | CH3COONa | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 11.6 | 10.3 | 11.1 | 11.3 |
(1)上述c和d溶液所含溶质对应的酸其酸性强弱为HClO>HCN(用化学式表示);
(2)结合表中数据分析,常温下与溶质a对水的电离程度影响相同的是B;
A.pH=8.8的NaOH溶液
B.pH=5.2的NH4Cl溶液
C.pH=5.2的盐酸
D.0.2mol•L-1的NaCN溶液
(3)用离子方程式表示c溶液呈碱性的原因是ClO-+H2O?HClO+OH-.
(4)如果将b溶液加入到含相同物质的量的BaCl2和ZnCl2的混合稀溶液中,首先析出的沉淀是ZnCO3[已知K(BaCO3)=5.1×10-9,K(ZnCO3)=1.4×10-11].
(5)浓度为0.1mol•L-1的e中离子浓度由大到小的顺序为c(Na+)>c(C6H5O?)>c(OH-)>c(H+).
(6)100℃时纯水中c(H+)=10-6mol•L-1,在此温度下某浓度的d溶液的pH=n,则c(H+)+c(HCN)=10n-12mol•L-1 .
19.若NA表示阿伏伽德罗常数,下列说法正确的是( )
| A. | 通常状况下14gN2中含有电子的数目为7NA | |
| B. | 标准状况下,22.4L水中含有水分子的数目为NA | |
| C. | 1molFe与足量稀盐酸反应时,转移电子的数目为3NA | |
| D. | 数目为NA的一氧化碳分子和0.5mol甲烷的质量比为7:4 |
18.X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6,下列说法正确的是( )
| A. | Y元素最高价氧化物对应水化物化学式H2YO4 | |
| B. | 原子半径由大到小的顺序为:Y>Z>X | |
| C. | X与W形成的两种化合物中,阴、阳离子物质的量之比均为1:2 | |
| D. | X、Z两种元素的气态氢化物中,Z的气态氢化物较稳定 |
17.近期在西非国家爆发的埃博拉疫情已得到初步控制,已知该病毒对化学药品敏感,乙醇、高锰酸钾溶液、次氯酸钠溶液、双氧水等消毒剂可以完全灭活病毒感染性,下列有关说法正确的是( )
0 167041 167049 167055 167059 167065 167067 167071 167077 167079 167085 167091 167095 167097 167101 167107 167109 167115 167119 167121 167125 167127 167131 167133 167135 167136 167137 167139 167140 167141 167143 167145 167149 167151 167155 167157 167161 167167 167169 167175 167179 167181 167185 167191 167197 167199 167205 167209 167211 167217 167221 167227 167235 203614
| A. | 乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 | |
| B. | 高锰酸钾溶液和双氧水的消毒原理相同 | |
| C. | 双氧水具有较强的腐蚀性,不能用于清洗创口 | |
| D. | 在次氯酸钠溶液中通入少量二氧化硫可得到亚硫酸钠和次氯酸 |
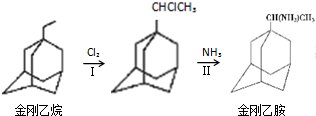
 ,如金刚乙烷表示为R-CH2CH3);
,如金刚乙烷表示为R-CH2CH3);
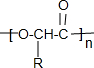 .
. .
.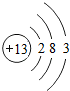 ,Al(OH)3的碱性比Mg(OH)2弱(填“强”或“弱”).
,Al(OH)3的碱性比Mg(OH)2弱(填“强”或“弱”). .
.
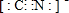
 某小组以废铁屑、稀硫酸、饱和(NH4)2 SO4溶液为原料,经过一系列反应和操作后,合成了浅蓝绿色晶体X,为确定其组成,进行如下实验:
某小组以废铁屑、稀硫酸、饱和(NH4)2 SO4溶液为原料,经过一系列反应和操作后,合成了浅蓝绿色晶体X,为确定其组成,进行如下实验: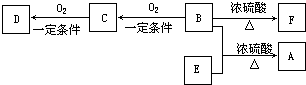 有机物A(C10H20O2)具有兰花香味,可用于香皂、洗发香波的芳香剂.A可通过如图所示的转化关系而制得.
有机物A(C10H20O2)具有兰花香味,可用于香皂、洗发香波的芳香剂.A可通过如图所示的转化关系而制得. .
.