题目内容
2.氢能的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、储氢合金、金属氢化物等.
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料.
①Ti2+基态的电子排布式可表示为1s22s22p63s23p63d2.
②BH4-的空间构造是正四面体(用文字描述).
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2$?_{输氢}^{储氢}$2NH3实现储氢和输氢.下列说法正确的是ABCD(多项选择).
A.NH3分子中N原子采用sP3杂化
B.相同压强时,NH3沸点比PH3高
C.[Cu(NH3)4]2+离子中,N原子是配位原子
D.CN-的电子式为
(3)2008年,Yoon等人发现Ca与C60(分子结构如图1)生成的Ca32C60能大量吸附H2分子.
①C60晶体易溶于苯、CS2,C60是非极性分子(填“极性”或“非极性”)
②1mol C60分子中,含有σ键数目为90NA.
(4)图乙是一种镍(Ni)镧合金储氢后的晶胞结构图,该合金储氢后,含0.5molNi的合金可吸附氢气的体积(标况)为6.72L.
(5)MgH2是金属氢化物储氢材料,其晶胞结构如图丙所示,已知该晶体的密度为密度为ag•cm-3,则晶胞的体积为$\frac{52}{a•NA}$cm3(用a、NA表示).
分析 (1)①钛是22号元素,Ti2+核外有20个电子,根据构造原理书写其基态核外电子排布式;
②根据价层电子对互斥理论确定空间构型;
(2)A.根据价层电子对互斥理论确定杂化方式;
B.同一主族元素的氢化物中,含有氢键的氢化物沸点较高;
C.提供孤电子对的原子是配位原子;
D.CN-的结构和氮气分子相似,根据氮气分子的电子式判断;
(3)①根据相似相溶原理确定分子的极性;
②利用均摊法计算;
(4)根据镍基合金储氢后的晶胞结构图,利用均摊法,可知每个晶胞中含有Ni、H2的个数关系来解答;
(5)先根据均摊法确定该晶胞中含有的各种原子个数,从而得出其质量,再根据V=$\frac{m}{ρ}$计算其体积;
解答 解:(1)①钛是22号元素,Ti2+核外有20个电子,根据构造原理知其基态核外电子排布式为:1s22s22p63s23p63d2;
故答案为:1s22s22p63s23p63d2;
②BH4-中B原子价层电子对=4+$\frac{1}{2}$(3+1-4×1)=4,且没有孤电子对,所以是正四面体结构;
故答案为:正四面体;
(2)A.NH3分子中N原子含有3个共用电子对和一个孤电子对,所以其价层电子对为4,采用sp3杂化,故A正确;
B.相同压强时,氨气中含有氢键,PH3中不含氢键,所以NH3沸点比PH3高,故B正确;
C.[Cu(NH3)4]2+离子中,N原子提供孤电子对,所以N原子是配位原子,故C正确;
D.CN-与氮气互为等电子体,结构与氮气相同,据此可以判断CN-的电子式为: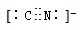 ,故D正确;
,故D正确;
故选:ABCD;
(3)①苯、CS2都是非极性分子,根据相似相溶原理知,C60是非极性分子;
故答案为:非极性;
②利用均摊法知,每个碳原子含有$\frac{1}{2}$×3=$\frac{3}{2}$个σ 键,所以1mol C60分子中,含有σ 键数目=$\frac{3}{2}$×1mol×60×NA/mol=90NA;
故答案为:90NA;
(4)根据镍基合金储氢后的晶胞结构图,利用均摊法,可知每个晶胞中Ni原子位于面心和体心,数目为1+8×$\frac{1}{2}$=5,H2分子位于面心和棱上,数目为2×$\frac{1}{2}$+8×$\frac{1}{4}$=3,所以当含0.5molNi的合金可吸附氢气可吸附H2的数目为0.3mol,体积为6.72L;
故答案为:6.72L;
(5)该晶胞中镁原子个数=$\frac{1}{8}$×8+1=2,氢原子个数=4×$\frac{1}{2}$+2=4,ρ=$\frac{m}{V}$=$\frac{\frac{(24×2+1×4)}{NA}}{ag•cm-3}$=$\frac{52}{a•NA}$;
故答案为:$\frac{52}{a•NA}$.
点评 本题考查物质结构和性质,涉及核外电子排布、杂化方式的判断、空间构型的判断、晶胞的计算等知识点,难点是晶胞的计算,灵活运用公式是解本题关键,难度中等.

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案| A. | 乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 | |
| B. | 高锰酸钾溶液和双氧水的消毒原理相同 | |
| C. | 双氧水具有较强的腐蚀性,不能用于清洗创口 | |
| D. | 在次氯酸钠溶液中通入少量二氧化硫可得到亚硫酸钠和次氯酸 |
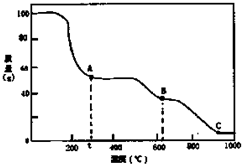
| A. | 0℃→t℃的过程变化是物理变化 | |
| B. | C点物质是工业上冶炼铝的原料 | |
| C. | A→B反应中生成物只有Al2(SO4)3和NH3两种 | |
| D. | Al2(SO4)3能够净水,其原理为:Al3++3OH?Al(OH)3 |
| A. | 四氯化碳的电子式 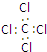 | B. | 乙炔的最简式 CH≡CH | ||
| C. | 聚乙烯的结构简式为 CH2=CH2 | D. | 丙烷的分子结构模型示意图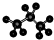 |
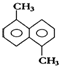
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |