题目内容
4.铝及其化合物在生产、生活中有重要应用.(1)铝的原子结构示意图为
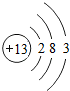 ,Al(OH)3的碱性比Mg(OH)2弱(填“强”或“弱”).
,Al(OH)3的碱性比Mg(OH)2弱(填“强”或“弱”).(2)铜制品镀铝后能有效防止钢材腐蚀,其原因是铝表面形成一层致密的氧化膜保护膜,阻止钢材与空气接触;为测定镀层的厚度,用NaOH溶液溶解铜制品表面的铝镀层,当反应转移6mol电子时,所得还原产物的物质的量为3mol.
(3)明矾[KAl(SO4)2•12H2O]是一种净水剂.将明矾溶于水,所得溶液中各离子的浓度由大到小的顺序为c(SO42-)>c(K+)>c(Al3+)>c(H+)>c(OH-).
(4)电解铝时,以熔融的NaAlCl4(以Na+、AlCl4-形式存在)为电解质,金属铝为阳极,铝电极的电极反应式为Al-3e-+4Cl-=AlCl4-.
(5)纳米活性氧化铝可用作氟乙烯聚合制取聚氯乙烯的催化剂.写出该反应的化学式:nCH2=CHCl$\stackrel{催化剂}{→}$
 .
.
分析 (1)根据原子核外电子排布画出原子结构示意图;元素的金属性越强最高价氧化物对应的水化物的碱性越强;
(2)根据铜制品镀铝后铝表面形成一层致密的氧化膜保护膜,阻止钢材与空气接触,可以有效防止钢材腐蚀;依据铝和氢氧化钠反应的化学方程式分析判断,还原产物为氢气;
(3)根据明矾[KAl(SO4)2•12H2O]溶于水发生电离KAl(SO4)2═K++Al3++2SO42-,其中铝离子要发生水解Al3++3H2O?Al(OH)3+3H+,使溶液中的铝离子减少,氢离子增多,据此分析;
(4)电解铝时,熔融的NaAlCl4为电解质,铝为阳极,被氧化生成AlCl4-,以此解答;
(5)氯乙烯在催化剂作用下发生加聚反应可生成聚氯乙烯.
解答 解:(1)Al是13号元素,元素的原子序数=其核外电子数=核内质子数,其核外电子排布是2,8,3,所以其原子结构示意图为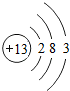 ,元素的金属性越强最高价氧化物对应的水化物的碱性越强,金属性Al<Mg,所以Al(OH)3的碱性比Mg(OH)2 弱,故答案为
,元素的金属性越强最高价氧化物对应的水化物的碱性越强,金属性Al<Mg,所以Al(OH)3的碱性比Mg(OH)2 弱,故答案为 ;弱;
;弱;
(2)铜制品镀铝后铝表面形成一层致密的氧化膜保护膜,阻止钢材与空气接触,可以有效防止钢材腐蚀;用NaOH溶液溶解铜制品表面的铝镀层,发生的反应为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,还原产物为氢气,当反应转移6mol电子时,所得还原产物的物质的量为3mol;
故答案为:铝表面形成一层致密的氧化膜保护膜,阻止钢材与空气接触;3;
(3)明矾[KAl(SO4)2•12H2O]溶于水发生电离KAl(SO4)2═K++Al3++2SO42-,其中铝离子要发生水解Al3++3H2O?Al(OH)3+3H+,使溶液中的铝离子减少,氢离子增多,所以溶液中各离子的浓度由大到小的顺序为c(SO42-)>c(K+)>c(Al3+)>c(H+)>c(OH-),
故答案为:c(SO42-)>c(K+)>c(Al3+)>c(H+)>c(OH-);
(4)电解铝时,熔融的NaAlCl4为电解质,电镀池中镀件金属铝作阳极,金属铝失电子发生氧化反应,Al-3e-+4Cl-=AlCl4-;
故答案为:阳;Al-3e-+4Cl-=AlCl4-;
(5)氯乙烯在催化剂作用下发生加聚反应可生成聚氯乙烯,方程式为:nCH2=CHCl$\stackrel{催化剂}{→}$ 故答案为:nCH2=CHCl$\stackrel{催化剂}{→}$
故答案为:nCH2=CHCl$\stackrel{催化剂}{→}$ .
.
点评 本题主要考查了铝及其化合物的知识,涉及到金属性的比较、电子转移的计算、溶液中离子浓度的大小比较、电解池的应用等,难度不大,抓住物质的基本性质是解题的关键.

 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案| A. | K+、NH4+、HCO3-、AlO2- | B. | K+、Cl-、Fe3+、SO42- | ||
| C. | K+、I-、ClO-、Na+ | D. | Na+、SO32-、S2-、Cl- |
| A. | 燃烧一定要用火去点燃 | |
| B. | 对“地沟油”进行分馏可得到汽油 | |
| C. | 2013年诺贝尔化学奖授予三位美国化学家,以表彰他们设计出多尺度复杂化学系统模型,将传统化学实验搬到了网络世界.这一完美结合现实与理论的化学系统模型,为更全面了解并预测化学反应进程奠定了基础 | |
| D. | 化肥的使用有效地提高了农作物的产量,常见的氮肥可分为铵态氮肥和硝态氮肥,硝酸盐和尿素都属于硝态氮肥 |
| 选项 | 现象或事实 | 解释 |
| A | 常温下将Al片放入浓硝酸中无明显变化 | Al与浓硝酸不反应 |
| B | 加热滴有酚酞的醋酸钠溶液,溶液红色变深 | 加热促进CH3COO-水解,溶液的碱性增强 |
| C | 将溴水分别滴入植物油和裂化汽油中,溴水均褪色 | 前者由于萃取而褪色,后者由于发生加成反应而褪色 |
| D | 加热NaHCO3溶液无明显变化 | NaHCO3的热稳定性强 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 通常状况下14gN2中含有电子的数目为7NA | |
| B. | 标准状况下,22.4L水中含有水分子的数目为NA | |
| C. | 1molFe与足量稀盐酸反应时,转移电子的数目为3NA | |
| D. | 数目为NA的一氧化碳分子和0.5mol甲烷的质量比为7:4 |
| A. | 由溴乙烷制乙烯;由石油制乙烯 | |
| B. | 由乙烯制乙烷;由乙醇制乙醛 | |
| C. | 乙烯使溴水褪色;甲苯使酸性KMnO4溶液褪色 | |
| D. | 由硝酸与苯反应制硝基苯;甲烷与Cl2光照 |
| A. | 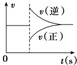 图可以表示对某化学平衡体系改变温度后反应速率随时间的变化 图可以表示对某化学平衡体系改变温度后反应速率随时间的变化 | |
| B. | 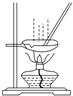 用图所示装置蒸发AlCl3溶液制备无水AlCl3 用图所示装置蒸发AlCl3溶液制备无水AlCl3 | |
| C. | 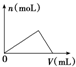 图可以表示向一定量的明矾溶液中逐滴滴加一定浓度氢氧化钡溶液时产生Al(OH)3沉淀的物质的量变化 图可以表示向一定量的明矾溶液中逐滴滴加一定浓度氢氧化钡溶液时产生Al(OH)3沉淀的物质的量变化 | |
| D. | 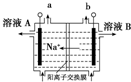 图电解饱和食盐水的装置中,溶液A、B中由水电离出的c(H+):A>B 图电解饱和食盐水的装置中,溶液A、B中由水电离出的c(H+):A>B |

| A. | 该分子中含有2种官能团 | |
| B. | 可与FeCl3溶液作用显紫色 | |
| C. | 1 mol莽草酸可与4 mol NaOH或2molBr2完全反应 | |
| D. | 在一定条件下,该物质既可发生加成反应也可发生取代反应 |