11.化学与科学、社会、技术和环境密切相关.下列有关说法中错误的是( )
| A. | 目前科学家已制得单原子层锗,其电子迁移率是硅的10倍,有望用于制造高能计算机芯片 | |
| B. | 2014年在西非国家爆发了埃博拉疫情,埃博拉病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 | |
| C. | 2014年德美科学家因开发超分辨荧光显微镜获诺贝尔化学奖,使光学显微镜分辨率步入了纳米时代,利用此类光显微镜可以观察活细胞内蛋白质等大分子 | |
| D. | 绿色化学期望利用化学原理从源头消除污染,在生产过程中充分利用原料,实现零排放 |
10.运用化学反应原理研究NH3的性质具有重要意义.请回答下列问题:
(1)利用对苯醌质子电池可检测氨气,其电池反应原理为2NH3+ (对苯醌)═N2H4+
(对苯醌)═N2H4+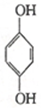 (对苯酚),N2H4的结构式为
(对苯酚),N2H4的结构式为 ,该电池正极的电极反应式为
,该电池正极的电极反应式为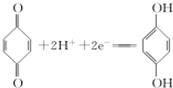 .
.
(2)25℃时,将nmol•L-1的氨水与0.1mol•L-1的盐酸等体积混合.
①若混合溶液中c(NH4+)=c(Cl-),则溶液的pH=7.
②若混合溶液中c(NH4+)>c(Cl-),则反应的情况可能为a.
a、盐酸不足,氨水剩余 b、氨水与盐酸恰好反应 c、盐酸过量
(3)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3N2(g)?2NH3(g)△H=bkJ•mol-1,其化学平衡常数K与温度的关系如下:
①写出该反应的化学平衡常数的表达式:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$,b小于(填“大于”“小于”或“等于”)0.
②400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的u正(N2)小于(填“大于”“小于”或“等于”)u正(N2).
(4)已知:①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
写出氨高温催化氧化的热化学方程式:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8KJ/mol.
(1)利用对苯醌质子电池可检测氨气,其电池反应原理为2NH3+
 (对苯醌)═N2H4+
(对苯醌)═N2H4+ (对苯酚),N2H4的结构式为
(对苯酚),N2H4的结构式为 ,该电池正极的电极反应式为
,该电池正极的电极反应式为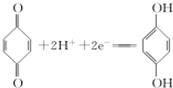 .
.(2)25℃时,将nmol•L-1的氨水与0.1mol•L-1的盐酸等体积混合.
①若混合溶液中c(NH4+)=c(Cl-),则溶液的pH=7.
②若混合溶液中c(NH4+)>c(Cl-),则反应的情况可能为a.
a、盐酸不足,氨水剩余 b、氨水与盐酸恰好反应 c、盐酸过量
(3)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3N2(g)?2NH3(g)△H=bkJ•mol-1,其化学平衡常数K与温度的关系如下:
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
②400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的u正(N2)小于(填“大于”“小于”或“等于”)u正(N2).
(4)已知:①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
写出氨高温催化氧化的热化学方程式:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8KJ/mol.
9.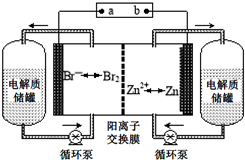 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )
 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )| A. | 放电时左侧电解质储罐中的离子总浓度增大 | |
| B. | 充电时电极a连接电源的负极 | |
| C. | 放电时负极的电极反应式为Zn-2e-═Zn2+ | |
| D. | 阳离子交换膜可阻止Br2与Zn直接发生反应 |
8.利用如图所示装置进行下列实验,能得出相应实验结论的是( )
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性Cl2>Br2 | |
| B | 浓氨水 | 碱石灰 | AgNO3溶液 | AgOH具有两性 | |
| C | 浓硫酸 | Na2SO3 | FeCl3溶液 | SO2具有还原性 | |
| D | 稀盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
| A. | A | B. | B | C. | C | D. | D |
7.25℃时,部分弱酸的电离平衡常数如表所示.下列反应的离子方程式书写错误的是( )
| 弱酸 | H2SO3 | HClO | H2CO3 |
| Ka1 | 1.54×10-2 | 2.95×10-8 | 4.30×10-7 |
| Ka2 | 1.02×10-7 | - | 5.61×10-11 |
| A. | NaClO溶液中通入少量CO2:ClO-+H2O+CO2═HCO3-+HClO | |
| B. | 氯水中加入少量NaCO3粉末:HCO3-+H+═H2O+CO2↑ | |
| C. | NaClO溶液中通入少量SO2:2ClO-+H2O+SO2═SO32-+2HClO | |
| D. | Na2CO2溶液中缓慢通入少量SO2:2CO32-+H2O+SO2═SO32-+2HCO3- |
6.下列物质中同分异构体数目最多的是( )
| A. | C2H6O | B. | C3H8O | C. | C3H6BrCl | D. | C4H9Cl |
5.用NA表示阿伏伽德罗常数的数值,下列叙述正确的是( )
| A. | 常温下,1mol丙烯中含碳原子数为3NA | |
| B. | 常温下,pH=13的NaOH溶液中含OH-数目为NA | |
| C. | 23gNa与足量氧气反应时转移的电子数为2NA | |
| D. | 标准状况下,22.4LCHCl3中含C-H键数目为NA |
4.一种高容量的固态锂电池以锂超离子固态导体(组成为Li30GeP2S12)为电解质,该锂电池能在-100℃至100℃之间的超宽温度范围内工作.下列说法不正确的是( )
| A. | Li的原子结构示意图为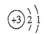 | B. | 原子半径:P>S | ||
| C. | 酸性:H3PO4<H2SO4 | D. | Li、Ge、P、S都属于短周期元素 |
3.近年来,雾霾频发,重污染天气频现,控制大气污染迫在眉睫.二氧化硫(SO2)和氮氧化物(NOx)等是主要大气污染物,消除大气污染有多种方法.
(1)处理NOx的一种方法是利用氨气非催化还原法将NOx还原为N2.已知还原1molNO约放出451.7kJ的热量,同时生成气态水,则该反应的热化学方程式为4NH3(g)+6NO(g)═5N2(g)+6H2O(g)△H=-2710.2kJ•mol-1.
(2)用活性炭还原法处理氮氧化物,其反应为C(s)+2NO(g)?N2(g)+CO2(g).某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如表:
①10min~20min以v(CO2)表示的平均反应速率为0.009mol•(L•min)-1.
②根据表中数据,计算T1℃时该反应的平衡常数为K=0.56(保留两位小数).
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率将不变 (填“增大”、“不变”或“减小”).
④下列各项能作为判断该反应达到平衡的是c、d (填序号字母);
a.容器内压强保持不变
b.2v正(NO)=v逆(N2)
c.容器内CO2的体积分数不变
d.混合气体的密度保持不变
⑤恒温恒容时,30min末改变某一条件,一段时间后反应重新达到平衡,则改变的条件可能是减小CO2的浓度.请在图1中画出30min至40min的变化曲线.
(3)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-而实现SO2的处理(总反应为2SO2+O2+2H2O═2H2SO4).已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+═4Fe3++2H2O,则另一反应的离子方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+.
(4)全钒氧化还原液流电池是目前发展势头强劲的优秀绿色环保储能电池.该电池的原理可用如图2所示装置示意,溶液中c(H+)=2.0mol•L-1,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色变为紫色.则该电池充电时b极接直流电源的负极(填“正极”或“负极”),a极的电极反应式为VO2++H2O-e-═VO2++2H+.若假设溶液温度、体积没有变化,则放电时右槽溶液的pH将增大(填“增大”、“减小”或“不变”).

0 167021 167029 167035 167039 167045 167047 167051 167057 167059 167065 167071 167075 167077 167081 167087 167089 167095 167099 167101 167105 167107 167111 167113 167115 167116 167117 167119 167120 167121 167123 167125 167129 167131 167135 167137 167141 167147 167149 167155 167159 167161 167165 167171 167177 167179 167185 167189 167191 167197 167201 167207 167215 203614
(1)处理NOx的一种方法是利用氨气非催化还原法将NOx还原为N2.已知还原1molNO约放出451.7kJ的热量,同时生成气态水,则该反应的热化学方程式为4NH3(g)+6NO(g)═5N2(g)+6H2O(g)△H=-2710.2kJ•mol-1.
(2)用活性炭还原法处理氮氧化物,其反应为C(s)+2NO(g)?N2(g)+CO2(g).某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如表:
浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
②根据表中数据,计算T1℃时该反应的平衡常数为K=0.56(保留两位小数).
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率将不变 (填“增大”、“不变”或“减小”).
④下列各项能作为判断该反应达到平衡的是c、d (填序号字母);
a.容器内压强保持不变
b.2v正(NO)=v逆(N2)
c.容器内CO2的体积分数不变
d.混合气体的密度保持不变
⑤恒温恒容时,30min末改变某一条件,一段时间后反应重新达到平衡,则改变的条件可能是减小CO2的浓度.请在图1中画出30min至40min的变化曲线.
(3)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-而实现SO2的处理(总反应为2SO2+O2+2H2O═2H2SO4).已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+═4Fe3++2H2O,则另一反应的离子方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+.
(4)全钒氧化还原液流电池是目前发展势头强劲的优秀绿色环保储能电池.该电池的原理可用如图2所示装置示意,溶液中c(H+)=2.0mol•L-1,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色变为紫色.则该电池充电时b极接直流电源的负极(填“正极”或“负极”),a极的电极反应式为VO2++H2O-e-═VO2++2H+.若假设溶液温度、体积没有变化,则放电时右槽溶液的pH将增大(填“增大”、“减小”或“不变”).

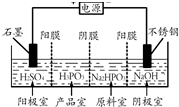 亚磷酸(H3PO3)可用作检测汞、金、银、铅、碘酸等的分析试剂.
亚磷酸(H3PO3)可用作检测汞、金、银、铅、碘酸等的分析试剂.