题目内容
8.利用如图所示装置进行下列实验,能得出相应实验结论的是( )| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性Cl2>Br2 | |
| B | 浓氨水 | 碱石灰 | AgNO3溶液 | AgOH具有两性 | |
| C | 浓硫酸 | Na2SO3 | FeCl3溶液 | SO2具有还原性 | |
| D | 稀盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
| A. | A | B. | B | C. | C | D. | D |
分析 A.浓盐酸和二氧化锰在加热条件下发生反应生成氯气,氯气可置换出溴;
B.AgOH溶于氨水,生成银氨络离子;
C.浓硫酸和亚硫酸钠生成二氧化硫气体;
D.比较非金属性,应用最高价氧化物对应的水化物.
解答 解:A.浓盐酸和二氧化锰在加热条件下发生反应生成氯气,氯气可置换出溴,如观察到烧杯中溶液变为橙红色,可说明氧化性Cl2>Br2,故A正确;
B.AgOH溶于氨水,生成银氨络离子,没有生成盐和水,不符合两性化合物的性质,故B错误;
C.浓硫酸和亚硫酸钠生成二氧化硫气体,二氧化硫具有还原性,可与FeCl3溶液发生氧化还原反应,可达到实验目的,故C正确;
D.比较非金属性,应用最高价氧化物对应的水化物,即应用高氯酸,且盐酸易挥发,二氧化碳气体中混有氯化氢,应先除杂,故D错误.
故选AC.
点评 本题考查较为综合,涉及氧化性、非金属性以及还原性的比较,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握实验的严密性和可行性的评价,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下表为元素周期表中的一部分,列出10种元素在元素周期表中的位置.试用元素符号、离子符号或化学式回答下列问题.
(1)10种元素中,化学性质最不活泼的是Ar;(填元素符号)
(2)①③⑤三种元素最高价氧化物对应水化物中,碱性最强的是NaOH;(填化学式)
(3)元素⑦的氢化物(10电子分子)的化学式为H2O;该氢化物常温下和元素①的单质反应的化学方程式2Na+2H2O=2NaOH+H2↑;
(4)元素⑧的最高价氧化物对应水化物的化学式为H3PO4;元素⑨的最高正化合价为+7,氢化物的化学式为HCl;
(5)元素①和⑤的最高价氧化物对应的水化物相互反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑨ | ⑩ | ||
| 4 | ② | ④ |
(2)①③⑤三种元素最高价氧化物对应水化物中,碱性最强的是NaOH;(填化学式)
(3)元素⑦的氢化物(10电子分子)的化学式为H2O;该氢化物常温下和元素①的单质反应的化学方程式2Na+2H2O=2NaOH+H2↑;
(4)元素⑧的最高价氧化物对应水化物的化学式为H3PO4;元素⑨的最高正化合价为+7,氢化物的化学式为HCl;
(5)元素①和⑤的最高价氧化物对应的水化物相互反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
16.乙酸乙酯的同分异构体中,存在丙基的有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 6种 |
3.近年来,雾霾频发,重污染天气频现,控制大气污染迫在眉睫.二氧化硫(SO2)和氮氧化物(NOx)等是主要大气污染物,消除大气污染有多种方法.
(1)处理NOx的一种方法是利用氨气非催化还原法将NOx还原为N2.已知还原1molNO约放出451.7kJ的热量,同时生成气态水,则该反应的热化学方程式为4NH3(g)+6NO(g)═5N2(g)+6H2O(g)△H=-2710.2kJ•mol-1.
(2)用活性炭还原法处理氮氧化物,其反应为C(s)+2NO(g)?N2(g)+CO2(g).某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如表:
①10min~20min以v(CO2)表示的平均反应速率为0.009mol•(L•min)-1.
②根据表中数据,计算T1℃时该反应的平衡常数为K=0.56(保留两位小数).
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率将不变 (填“增大”、“不变”或“减小”).
④下列各项能作为判断该反应达到平衡的是c、d (填序号字母);
a.容器内压强保持不变
b.2v正(NO)=v逆(N2)
c.容器内CO2的体积分数不变
d.混合气体的密度保持不变
⑤恒温恒容时,30min末改变某一条件,一段时间后反应重新达到平衡,则改变的条件可能是减小CO2的浓度.请在图1中画出30min至40min的变化曲线.
(3)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-而实现SO2的处理(总反应为2SO2+O2+2H2O═2H2SO4).已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+═4Fe3++2H2O,则另一反应的离子方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+.
(4)全钒氧化还原液流电池是目前发展势头强劲的优秀绿色环保储能电池.该电池的原理可用如图2所示装置示意,溶液中c(H+)=2.0mol•L-1,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色变为紫色.则该电池充电时b极接直流电源的负极(填“正极”或“负极”),a极的电极反应式为VO2++H2O-e-═VO2++2H+.若假设溶液温度、体积没有变化,则放电时右槽溶液的pH将增大(填“增大”、“减小”或“不变”).

(1)处理NOx的一种方法是利用氨气非催化还原法将NOx还原为N2.已知还原1molNO约放出451.7kJ的热量,同时生成气态水,则该反应的热化学方程式为4NH3(g)+6NO(g)═5N2(g)+6H2O(g)△H=-2710.2kJ•mol-1.
(2)用活性炭还原法处理氮氧化物,其反应为C(s)+2NO(g)?N2(g)+CO2(g).某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如表:
浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
②根据表中数据,计算T1℃时该反应的平衡常数为K=0.56(保留两位小数).
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率将不变 (填“增大”、“不变”或“减小”).
④下列各项能作为判断该反应达到平衡的是c、d (填序号字母);
a.容器内压强保持不变
b.2v正(NO)=v逆(N2)
c.容器内CO2的体积分数不变
d.混合气体的密度保持不变
⑤恒温恒容时,30min末改变某一条件,一段时间后反应重新达到平衡,则改变的条件可能是减小CO2的浓度.请在图1中画出30min至40min的变化曲线.
(3)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-而实现SO2的处理(总反应为2SO2+O2+2H2O═2H2SO4).已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+═4Fe3++2H2O,则另一反应的离子方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+.
(4)全钒氧化还原液流电池是目前发展势头强劲的优秀绿色环保储能电池.该电池的原理可用如图2所示装置示意,溶液中c(H+)=2.0mol•L-1,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色变为紫色.则该电池充电时b极接直流电源的负极(填“正极”或“负极”),a极的电极反应式为VO2++H2O-e-═VO2++2H+.若假设溶液温度、体积没有变化,则放电时右槽溶液的pH将增大(填“增大”、“减小”或“不变”).

13.下列说法正确的是( )
| A. | 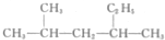 的名称为2-甲基-4-乙基戊烷 的名称为2-甲基-4-乙基戊烷 | |
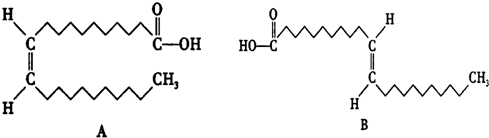
| B. |  互为同分异构体 互为同分异构体 | |
| C. | 糖类、油脂、蛋白质的水解产物都是非电解质 | |
| D. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 |
20.化学与生产、生活密切相关.下列说法错误的是( )
| A. | 研发易降解的生物农药符合十八大报告中提到的生态文明建设 | |
| B. | 熟吃西红柿要比生吃维生素C的损失小 | |
| C. | 教育部发出禁令是因为吸烟也会产生多种有害有毒物质 | |
| D. | 大量焚烧田间秸秆会产生雾霾而影响空气质量 |
17.偏二甲肼( )是运载火箭的主体燃料.C2H8N2物质中含碳碳单键的同分异构体共有( )
)是运载火箭的主体燃料.C2H8N2物质中含碳碳单键的同分异构体共有( )
 )是运载火箭的主体燃料.C2H8N2物质中含碳碳单键的同分异构体共有( )
)是运载火箭的主体燃料.C2H8N2物质中含碳碳单键的同分异构体共有( )| A. | 2种 | B. | 3 种 | C. | 4种 | D. | 5种 |
18.关于有机物的叙述正确的是( )
| A. | 丙烷的二卤代物是4种,则其六卤代物是2种 | |
| B. | 对二甲苯的核磁共振氢谱显示有3种化学环境的氢 | |
| C. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有3种 | |
| D. | 某烃的同分异构体只能形成一种一氯代物,其分子式可能为C5H12 |