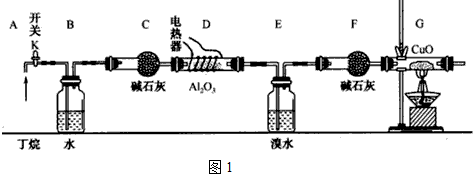
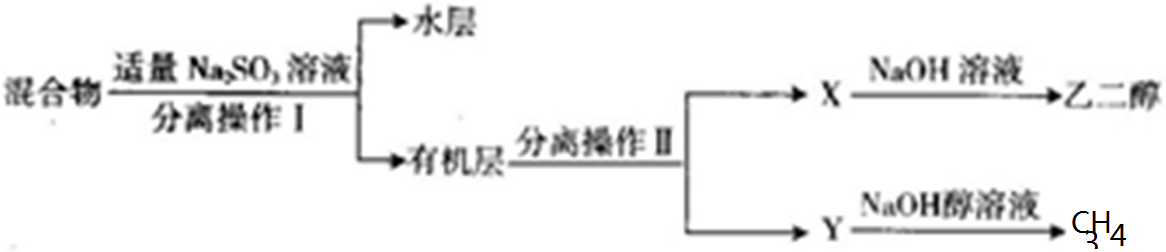
题目内容
9.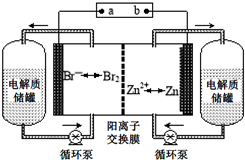 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )| A. | 放电时左侧电解质储罐中的离子总浓度增大 | |
| B. | 充电时电极a连接电源的负极 | |
| C. | 放电时负极的电极反应式为Zn-2e-═Zn2+ | |
| D. | 阳离子交换膜可阻止Br2与Zn直接发生反应 |
分析 放电时,该装置是原电池,Zn易失电子作负极,电极反应式为Zn-2e-═Zn2+,正极反应式为Br2+2e-=2Br-,充电时,阳极、阴极与正极、负极电极反应式正好相反,阳离子交换膜只能阳离子通过,分子或阴离子不能通过,据此分析解答.
解答 解:A.放电时,左侧为正极,电极反应式为Br2+2e-=2Br-,且氧离子从右侧通入阳离子交换膜进入左侧,所以左侧电解质储罐中的离子总浓度增大,故A正确;
B.充电时,a极为阳极,应该连接电源正极,故B错误;
C.放电时,负极上Zn失电子发生氧化反应,电极反应式为Zn-2e-═Zn2+,故C正确;
D.阳离子交换膜只能阳离子通过,分子或阴离子不能通过,所以阳离子交换膜可阻止Br2与Zn直接发生反应,故D正确;
故选B.
点评 本题考查化学电源新型电池,为高考高频点,明确各个电极上发生的反应是解本题关键,知道正负极与阴阳极电极反应式的关系,知道离子交换膜作用,题目难度不大.

练习册系列答案
相关题目
12.下列关于NO的叙述正确的是( )
| A. | NO是一种红棕色的气体 | |
| B. | 常温常压下NO不能与空气中的氧气直接化合 | |
| C. | 含等质量的氧元素的NO和CO的物质的量相等 | |
| D. | NO易溶于水,不能用排水法收集 |
20.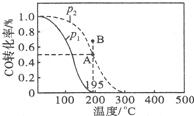 甲醇是重要的化工原料,在化工生产中有广泛的应用.
甲醇是重要的化工原料,在化工生产中有广泛的应用.
(1)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢反应生成H2和甲酸甲酯(HCOOCH3)、再分解生成CO和CH3OH.写出相应反应的化学方程式:2CH3OH→HCOOCH3+2H2↑、HCOOCH3→CH3OH+CO↑.
(2)利用太阳能或生物质能分解水制H2,然后可将H2与C02转化为甲醇.已知:
光催化制氢:2H2O(1)=2H2(g)+O2(g)△H=+571.5kJ•mol-1
H2与C02耦合反应:3H2(g)十CO2(g)=CH3OH(1)+H2O(1)△H=一137.8kJ•mol-1
则反应:2H2O(1)+CO2(g)=CH30H(l)+3/202(g)的△H=+719.45 kJ•mol-1
(3)已知反应:CO(g)+2H2(g)?CH3OH(g)△H=Q
在20L的密闭容器中,按物质的量之比1:2充入CO和H2,测得CO的转化率随温度及压强的变化如图所示,P2及195℃时n(H2)随时间的变化如表所示:
①O~3min,平均速率V(CH3OH)=0.033mol/(L.min),Q<0(填“<”“=”或“>”).
②图中压强(P1、P2)的大小顺序为P1<P2,理由是相同温度下,压强P2平衡时CO的转化率更大,而正反应为气体体积减小的反应,增大压强平衡向正反应方向移动,CO的转化率提高.
③在P2及195℃时,该反应的平衡常数K=25.
 甲醇是重要的化工原料,在化工生产中有广泛的应用.
甲醇是重要的化工原料,在化工生产中有广泛的应用.(1)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢反应生成H2和甲酸甲酯(HCOOCH3)、再分解生成CO和CH3OH.写出相应反应的化学方程式:2CH3OH→HCOOCH3+2H2↑、HCOOCH3→CH3OH+CO↑.
(2)利用太阳能或生物质能分解水制H2,然后可将H2与C02转化为甲醇.已知:
光催化制氢:2H2O(1)=2H2(g)+O2(g)△H=+571.5kJ•mol-1
H2与C02耦合反应:3H2(g)十CO2(g)=CH3OH(1)+H2O(1)△H=一137.8kJ•mol-1
则反应:2H2O(1)+CO2(g)=CH30H(l)+3/202(g)的△H=+719.45 kJ•mol-1
(3)已知反应:CO(g)+2H2(g)?CH3OH(g)△H=Q
在20L的密闭容器中,按物质的量之比1:2充入CO和H2,测得CO的转化率随温度及压强的变化如图所示,P2及195℃时n(H2)随时间的变化如表所示:
| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8 | 5 | 4 | 4 |
②图中压强(P1、P2)的大小顺序为P1<P2,理由是相同温度下,压强P2平衡时CO的转化率更大,而正反应为气体体积减小的反应,增大压强平衡向正反应方向移动,CO的转化率提高.
③在P2及195℃时,该反应的平衡常数K=25.
17.用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1mol甲苯含C-H键的数目为6NA | |
| B. | 反应5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O中生成28gN2时,转移电子数目为15NA | |
| C. | 1molFeCl3与水反应完全转化为氢氧化铁胶体后,胶体粒子的数目为NA | |
| D. | 含有4.6g钠元素的过氧化钠和氧化钠的混合物中,所含离子总数为0.3NA |
4.一种高容量的固态锂电池以锂超离子固态导体(组成为Li30GeP2S12)为电解质,该锂电池能在-100℃至100℃之间的超宽温度范围内工作.下列说法不正确的是( )
| A. | Li的原子结构示意图为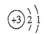 | B. | 原子半径:P>S | ||
| C. | 酸性:H3PO4<H2SO4 | D. | Li、Ge、P、S都属于短周期元素 |
14.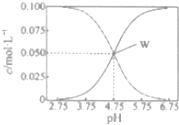 25℃时,有c(CH2COOH)+c(CH2COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH2COOH)、c(CH2COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的叙述不正确的是( )
25℃时,有c(CH2COOH)+c(CH2COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH2COOH)、c(CH2COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的叙述不正确的是( )
 25℃时,有c(CH2COOH)+c(CH2COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH2COOH)、c(CH2COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的叙述不正确的是( )
25℃时,有c(CH2COOH)+c(CH2COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH2COOH)、c(CH2COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的叙述不正确的是( )| A. | 25℃时,醋酸的电离常数Ka=1×10-4.75 | |
| B. | W点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-) | |
| C. | pH=5.5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol•L-1 |
1.下列有关化学用语的各种表示正确的是( )
| A. | 电子式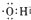 可以表示烃基,也可以表示氢氧根离子 可以表示烃基,也可以表示氢氧根离子 | |
| B. | 磷原子的简化电子排布式:[He]3s23p3 | |
| C. | 聚丙烯链节的结构简式为:-CH2-CH-CH2- | |
| D. | 用惰性电极电解MgCl2溶液的离子方程式为:Mg2++2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+Mg(OH)2↓ |
19.钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,充电时,总反应为Na2Sx═2Na+xS(3<x<5),其反应原理如图所示,下列说法错误的是( )


| A. | 放电时,电极A为负极 | |
| B. | 该电池工作的适宜温度应控制10℃左右 | |
| C. | 放电时,内电路中Na+的移动方向为A到B | |
| D. | 充电时,阳极的电极反应式为 Sx2--2e-═xS |