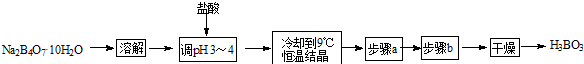
15.为了检验某溴代烃中的溴元素,现进行如下操作,其中合理的是( )
| A. | 取溴代烃少许,加入AgNO3溶液 | |
| B. | 取溴代烃少许与NaOH水溶液共热,然后加入AgNO3溶液 | |
| C. | 取溴代烃少许与NaOH乙醇溶液共热后,加入稀硝酸酸化后,再加入AgNO3溶液 | |
| D. | 取溴代烃少许与NaOH水溶液共热后,加入稀硝酸酸化后,再加入AgNO3溶液 |
14.柠檬烯是一种食用香料,其结构为;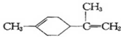 有关柠檬烯的分析正确的是( )
有关柠檬烯的分析正确的是( )
 有关柠檬烯的分析正确的是( )
有关柠檬烯的分析正确的是( )| A. | 柠檬烯的一氯代物有9种 | |
| B. | 柠檬烯和丁基苯(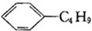 )互为同分异构体 )互为同分异构体 | |
| C. | 柠檬烯的分子中所有的碳原子可能在同一个平面上 | |
| D. | 一定条件下,柠檬烯可以发生加成、取代、氧化等反应 |
13.下列关于 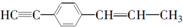 的说法中正确的是( )
的说法中正确的是( )
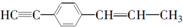 的说法中正确的是( )
的说法中正确的是( )| A. | 有7个碳原子可能在同一直线上 | |
| B. | 只可能有5个碳原子在同一直线上 | |
| C. | 最多只可能有9个碳原子在同一平面上 | |
| D. | 所有原子都可能在同一平面上 |
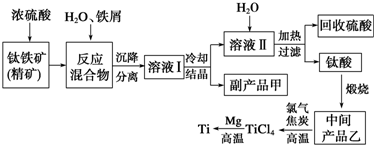
12.为了提纯下表所列物质(括号内为杂质),有关除杂试剂和分离方法的选择均正确的是( )
| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 己烷(己烯) | 溴水 | 分液 |
| B | 淀粉溶液(NaCl) | 水 | 过滤 |
| C | CH3CH2OH(CH3COOH) | CaO | 蒸馏 |
| D | CO2(SO2) | Na2CO3溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
11.在一定温度下,将6mol CO2和8mol H2充入2L恒容密闭容器中,发生如下反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<O
分别在t时测得在该容器内n(H2)的数值如下:
则下列说法正确的是( )
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<O
分别在t时测得在该容器内n(H2)的数值如下:
| t/min | 1 | 4 | 8 | 11 |
| n(H2)/mol | 6 | 2.6 | 2 | 2 |
| A. | 该温度下,平衡常数K=0.5 | |
| B. | 反应进行4min时,V(C02)=0.45 mol/(L•min) | |
| C. | 反应进行到9min时,H2的转化率比8min时高 | |
| D. | 反应进行11min后,若增大容器内压强,CO2的转化率一定增大 |
10.通常海水的pH=8.1,在稳定海水pH中起作用的离子是( )
0 166978 166986 166992 166996 167002 167004 167008 167014 167016 167022 167028 167032 167034 167038 167044 167046 167052 167056 167058 167062 167064 167068 167070 167072 167073 167074 167076 167077 167078 167080 167082 167086 167088 167092 167094 167098 167104 167106 167112 167116 167118 167122 167128 167134 167136 167142 167146 167148 167154 167158 167164 167172 203614
| A. | Na+ | B. | HCO3- | C. | CO32- | D. | Cl- |
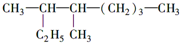 的名称是3,4一二甲基辛烷,
的名称是3,4一二甲基辛烷, ,1mol该烃完全燃烧需消耗氧气18.5mol,
,1mol该烃完全燃烧需消耗氧气18.5mol,