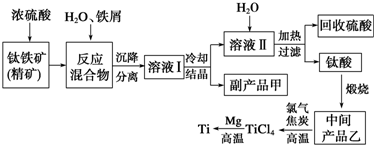
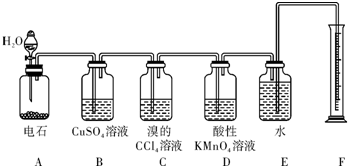
题目内容
11.在一定温度下,将6mol CO2和8mol H2充入2L恒容密闭容器中,发生如下反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<O
分别在t时测得在该容器内n(H2)的数值如下:
| t/min | 1 | 4 | 8 | 11 |
| n(H2)/mol | 6 | 2.6 | 2 | 2 |
| A. | 该温度下,平衡常数K=0.5 | |
| B. | 反应进行4min时,V(C02)=0.45 mol/(L•min) | |
| C. | 反应进行到9min时,H2的转化率比8min时高 | |
| D. | 反应进行11min后,若增大容器内压强,CO2的转化率一定增大 |
分析 A.由表中数据可知,8min与11min时氢气的物质的量相等,说明8min时反应已经到达平衡状态,利用三段式计算平衡时各组成的浓度,代入平衡常数表达式K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$计算;
B.根据v=$\frac{\frac{△n}{V}}{△t}$计算v(H2),再利用速率之比等于其化学计量数之比计算V(CO2);
C.8min时反应已经到达平衡状态;
D.恒容密闭容器,若通入稀有气体使容器内压强增大,反应混合物的浓度不变化,平衡不移动.
解答 解:A.由表中数据可知,8min与11min时氢气的物质的量相等,说明8min时反应已经到达平衡状态,CO2和 H2的起始浓度分别为$\frac{6mol}{2L}$=3mol/L、$\frac{8mol}{2L}$=4mol/L,平衡时氢气浓度为$\frac{2mol}{2L}$=1mol/L,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始(mol/L):3 4 0 0
转化(mol/L):1 4-1=3 1 1
平衡(mol/L):2 1 1 1
B.4min内参加反应氢气为8mol-2.6mol=5.4mol,故v(H2)=$\frac{\frac{5.4mol}{2L}}{4min}$=0.675mol/(L.min),速率之比等于其化学计量数之比,故V(CO2)=$\frac{1}{3}$v(H2)=$\frac{1}{3}$×0.675mol/(L.min)=0.225mol/(L.min),故B错误;
C.8min时反应已经到达平衡状态,反应进行到9min时,氢气转化率与比8min时的转化率相等,故C错误;
D.恒容密闭容器,若通入稀有气体使容器内压强增大,反应混合物的浓度不变化,平衡不移动,故增大容器内压强,CO2的转化率可能增大,可能减小,也可能不变,故D错误,
故选A.
点评 本题考查化学平衡常数计算、反应速率计算、化学平衡影响因素等,关键是根据氢气的物质的量不变判断平衡,D选项为易错点,注意分析压强变化是否引起反应各组分的浓度变化.

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案| A. | 都属于氧化还原反应 | |
| B. | 等物质的量的上述物质产生气体体积(相同状况)的大小关系是:Na2O2=CaC2<CaH2=Mg3N2 | |
| C. | Na2O2、CaH2与水反应时水作氧化剂 | |
| D. | CaH2与水反应时产生H2,它既是氧化产物和又是还原产物 |
| A. | 同周期主族元素的原子半径以ⅦA族的为最大 | |
| B. | 在周期表中零族元素的单质常温常压下全部是气体 | |
| C. | ⅠA、ⅡA族元素的原子,其半径越大就越容易得电子 | |
| D. | 非金属元素的最低负价都和它的族序数相等 |
| A. | 二氧化硅晶体的分子式:SiO2 | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | F-离子结构示意图: | D. | 四氯化碳的电子式: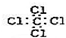 |
| A. | C4H10 | B. | C3H8 | C. | CH4 | D. | C2H6 |
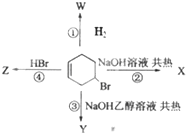
| A. | ① | B. | ①③④ | C. | ② | D. | ①②④ |
 ;化合物BA4的电子式为
;化合物BA4的电子式为 .
. .
.