5.把一块镁铝合金投入到过量1mol/L HCl溶液里,待合金完全溶解后,往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如下图A所示.下列说法中不正确的是( )
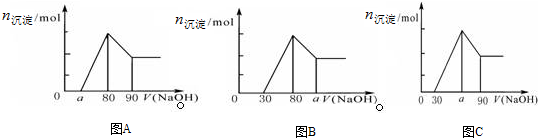

| A. | a的取值范围为 0≤a<50 | |
| B. | $\frac{n(Mg)}{n(Al)}$的最大值为2.5 | |
| C. | 若将关系图改为B图时,则a的取值范围为80<a<90 | |
| D. | 若将关系图改为C图时,则a的取值范围为75<a<90 |
4.将铜粉放入稀硫酸中,加热无明显反应发生.但加入某物质后,发现铜粉质量逐渐减少,该物质不可能是( )
| A. | Fe2(SO4)3 | B. | ZnSO4 | C. | KNO3 | D. | O2 |
3.在FeCl3和CuCl2的混和溶液中,加入过量Fe粉,完全反应后,余下固体的质量与所加Fe粉质量相等,则原混和液中FeCl3和CuCl2的物质的量浓度之比为( )
| A. | 7:2 | B. | 2:7 | C. | 1:2 | D. | 2:1 |
2.Na2O2、CaC2、CaH2、Mg3N2都能与水反应,且反应中均有气体放出.下列说法正确的是( )
| A. | 都属于氧化还原反应 | |
| B. | 等物质的量的上述物质产生气体体积(相同状况)的大小关系是:Na2O2=CaC2<CaH2=Mg3N2 | |
| C. | Na2O2、CaH2与水反应时水作氧化剂 | |
| D. | CaH2与水反应时产生H2,它既是氧化产物和又是还原产物 |
20.元素处于基态时的气态原子获得一个电子成为-1价阴离子时所放出的能量叫做该元素的第一电子亲合能.-1价阴离子再获得一个电子的能量变化叫做第二电子亲合能.下表中给出了几种元素或离子的电子亲合能数据;:
下列说法不正确的是( )
| 元素 | Li | Na | K | O | O- | F |
| 电子亲合能/kJ•mol-1 | 59.8 | 52.7 | 48.4 | 141 | -780 | 327.9 |
| A. | 电子亲合能越大,说明越容易得到电子 | |
| B. | 一个基态的气态氟原子得到一个电子成为氟离子时放出327.9kJ的能量 | |
| C. | 元素的第一电子亲和能同主族的从上到下逐渐减小,同周期从左到右则逐渐增大 | |
| D. | 基态的气态氧原子得到两个电子成为O2-需要吸收能量 |
19.构造原理揭示的电子排布能级顺序,实质是各能级能量高低,若以E表示某能级的能量,下列能量大小顺序中正确的是( )
| A. | E(4s)>E(3p)>E(3d) | B. | E(3s)>E(3p)>E(3d) | C. | E(6s)>E(4f)>E(5d) | D. | E(5s)>E(4p)>E(3d) |
18.已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,有关A、B、C、D四种元素的叙述中正确的是( )
| A. | 原子序数:b>a>c>d | B. | 原子半径:A>B>C>D | ||
| C. | 金属性:B>A,非金属性:D>C | D. | 离子半径:D>C>B>A |
17.居室装修用石材的放射性${\;}_{88}^{226}$Ra常用作为标准,居里夫人(Marie Curie)因对Ra元素的研究两度获得诺贝尔奖.下列叙述中正确的是( )
0 166975 166983 166989 166993 166999 167001 167005 167011 167013 167019 167025 167029 167031 167035 167041 167043 167049 167053 167055 167059 167061 167065 167067 167069 167070 167071 167073 167074 167075 167077 167079 167083 167085 167089 167091 167095 167101 167103 167109 167113 167115 167119 167125 167131 167133 167139 167143 167145 167151 167155 167161 167169 203614
| A. | 一个${\;}_{88}^{226}$Ra原子中含有138个中子 | |
| B. | Ra元素位于元素周期表中第六周期ⅡA族 | |
| C. | Ra不能和冷水反应置换氢气 | |
| D. | Ra(OH)2是一种两性氢氧化物 |
 As
As

 ,写出正确的合成路线:
,写出正确的合成路线: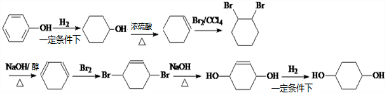 .
.