题目内容
5.把一块镁铝合金投入到过量1mol/L HCl溶液里,待合金完全溶解后,往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如下图A所示.下列说法中不正确的是( )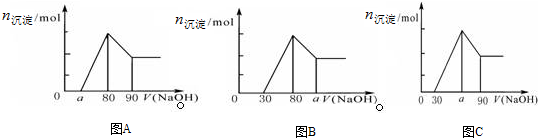
| A. | a的取值范围为 0≤a<50 | |
| B. | $\frac{n(Mg)}{n(Al)}$的最大值为2.5 | |
| C. | 若将关系图改为B图时,则a的取值范围为80<a<90 | |
| D. | 若将关系图改为C图时,则a的取值范围为75<a<90 |
分析 A.根据第三阶段的反应确定铝离子的物质的量,假设只有铝离子时,根据消耗的氢氧化钠来确定a的取值范围;
B.根据第三阶段的反应确定铝离子的物质的量,所以铝离子生成氢氧化铝所需的氢氧化钠的物质的量一定,根据a的取值判断镁的物质的量;
C.采用极值法计算,当没有铝离子时,a值最小,当生成的沉淀全部是氢氧化铝时,a值最大;
D.采用极值法计算,当没有铝离子时,a值最大,当生成的沉淀全部是氢氧化铝时,a值最小.
解答 解:A.第三阶段,氢氧化铝溶解Al(OH)3+NaOH=NaAlO2+2H2O,因为此时消耗NaOH10mL,所以n(Al3+)=0.01mol;第二阶段,氢氧化铝沉淀Al3++3OH-=Al(OH)3,该过程需要NaOH0.03mol,体积为30mL,假设无Mg2+,a=50,而实际存在Mg2+,当没有盐酸剩余时,a=0,所以0≤a<50,故A正确;
B.第三阶段,氢氧化铝溶解Al(OH)3+NaOH=NaAlO2+2H2O,因为此时消耗NaOH10mL,所以n(Al3+)=n(Al)=0.01mol;第二阶段,氢氧化铝沉淀Al3++3OH-=Al(OH)3,该过程需要NaOH0.03mol,体积为30mL;当a=0时,盐酸没有剩余,与氢氧化钠反应的离子是镁离子和铝离子,铝离子一定,镁离子物质的量最大,此时与镁离子反应的氢氧化钠的体积=80mL-30mL=50mL,50mL氢氧化钠的物质的量为0.05mol,镁离子的物质的量是0.025mol,所以$\frac{n(Mg)}{n(Al)}$=$\frac{0.025mol}{0.01mol}$=2.5,即$\frac{n(Mg)}{n(Al)}$的最大值为2.5,故B正确;
C.采用极值法计算,当没有铝离子时,生成的沉淀不和氢氧化钠反应导致a值最小,80=a;当生成的沉淀全部是氢氧化铝时,氢氧化铝能和氢氧化钠反应生成偏铝酸钠,导致a值最大,生成氢氧化铝沉淀所用的氢氧化钠体积是溶解氢氧化铝所用氢氧化钠体积的3倍,所以溶解氢氧化铝所用氢氧化钠的体积为$\frac{50}{3}$,a=96.7,实际上存在镁离子,所以a的取值范围是80<a<96.7,故C错误;
D.采用极值法计算,当没有铝离子时,生成的沉淀全部是氢氧化镁,氢氧化镁和氢氧化钠不反应,此时a值最大为90;当生成的沉淀全部是氢氧化铝,生成的氢氧化铝又能和氢氧化钠完全转化为偏铝酸钠时a值最小,生成氢氧化铝所用的氢氧化钠与溶解氢氧化铝所用的氢氧化钠的体积之比=3:1,所以a=$\frac{90-30}{4}$=75,实际上溶液中含有铝离子和镁离子,所以a的取值范围是75<a<90,故D正确;
故选C.
点评 本题考查混合物反应的计算,题目难度中等,结合图象进行考查,增大了难度,明确生成氢氧化铝所用的氢氧化钠与溶解氢氧化铝所用的氢氧化钠的体积之比=3:1是解本题的关键.

| A. | c(NH4+)>c(SO42-)>c(H+)>c(OH-) | B. | c(SO42-)>c(NH4+)>c(OH-)>c(H+) | ||
| C. | c(NH4+)>c(SO42)>c(OH-)>c(H+) | D. | c(SO42-)>c(H+)>c(NH4+)>c(OH-) |
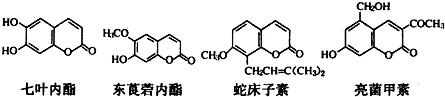
| A. | 七叶内酯与东茛菪内酯互为同系物 | |
| B. | 四种化合物含有的官能团种类完全相同 | |
| C. | l mol上述四种物质与足量氢氧化钠溶液反应,消耗氢氧化钠最多的是亮菌甲素 | |
| D. | 它们都能使溴的四氯化碳溶液褪色 |
| 元素 | Li | Na | K | O | O- | F |
| 电子亲合能/kJ•mol-1 | 59.8 | 52.7 | 48.4 | 141 | -780 | 327.9 |
| A. | 电子亲合能越大,说明越容易得到电子 | |
| B. | 一个基态的气态氟原子得到一个电子成为氟离子时放出327.9kJ的能量 | |
| C. | 元素的第一电子亲和能同主族的从上到下逐渐减小,同周期从左到右则逐渐增大 | |
| D. | 基态的气态氧原子得到两个电子成为O2-需要吸收能量 |
| A. | 甲、乙中铝都有剩余 | |
| B. | 铝片的质量是5.4 g | |
| C. | 盐酸或氢氧化钠的物质的量浓度为0.1 mol/L | |
| D. | 盐酸或氢氧化钠的物质的量浓度为0.2 mol/L |
| A | B | C | D | |
| 正极 | Fe | C | Cu | Zn |
| 负极 | Cu | Fe | Fe | Fe |
| 电解质溶液 | CuSO4 | H2SO4 | CuCl2 | CuSO4 |
| A. | A | B. | B | C. | C | D. | D |
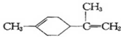 有关柠檬烯的分析正确的是( )
有关柠檬烯的分析正确的是( )| A. | 柠檬烯的一氯代物有9种 | |
| B. | 柠檬烯和丁基苯(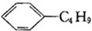 )互为同分异构体 )互为同分异构体 | |
| C. | 柠檬烯的分子中所有的碳原子可能在同一个平面上 | |
| D. | 一定条件下,柠檬烯可以发生加成、取代、氧化等反应 |
| A. | 通入足量的酸性KMnO4溶液 | B. | 在Ni催化、加热条件下通入H2 | ||
| C. | 通过足量的溴水 | D. | 通过足量的NaOH溶液 |